Цель работы: научиться готовить растворы с различными концентрациями.
Задачи: 1) сделать расчеты и приготовить раствор в соответствии с полученным заданием;
2) определить плотность приготовленного раствора;
3) используя значение плотности раствора и метод интерполяции, определить массовую долю растворенного вещества в растворе.
Реактивы и оборудование: 1) CuSO4×5H2O (или Na2СО3×10Н2O); 2) технические весы, 3) набор ареометров; 4) пергаментная бумага или калька; 5) коническая колба на 100 мл; 6) мерная колба на 50 мл; 7) мерные цилиндры на 50, 100мл; 8) воронка; 9) стеклянная палочка.
Растворы – гомогенные смеси переменного состава. Растворы состоят из растворенного вещества и растворителя. Растворителем называют компонент, который сохраняет свое фазовое состояние при образовании раствора и его концентрация выше концентрации других компонентов. Концентрация раствора указывает на количественный состав раствора.
Существует несколько способов выражения концентрации растворов.
1. Массовая доля вещества w - показывает массу растворенного вещества в 100 г раствора:
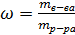 ,
,
где mв-ва – масса растворенного вещества, г;
m р-ра – масса раствора, г;
m р-ра = mв-ва + m р-ля
Массовая доля может быть выражена в процентах – процентная концентрация:
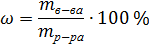
Например, 5 % - ный раствор NaCl, значит в 100 г раствора содержится 5 г NaCl, а для приготовления 100 г 5 % - ного раствора необходимо 5 г NaCl растворить в 95 г воды.
2. Молярная концентрация вещества См – показывает количество моль растворенного вещества в 1 литре раствора, размерность моль/л или М:
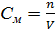 ,
,
где n – количество моль растворенного вещества, моль;
V – объем раствора, л.
Например, для приготовления 0,5 М раствора NaNO3 необходимо 0,5 моль вещества поместить в мерную колбу на 1 л, растворить в небольшом количестве воды, далее объем раствора довести до метки.
3. Эквивалентная концентрация или нормальная концентрация Сн – показывает количество моль – эквивалентов растворенного вещества в 1 литре раствора, размерность моль – экв/л или н:
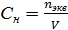 ,
,
где nэкв – количество моль – эквивалентов растворенного вещества, моль – экв;
V – объем раствора, л.
Например, для приготовления 0,5 н раствора Ca(NO3)2 необходимо 0,5 моль - эквивалентов вещества поместить в мерную колбу на 1 л, растворить в небольшом количестве воды, далее объем раствора довести до метки.
4. Мольная доля, c – величина, показывающая отношение количества молей данного вещества ni к общему количеству молей всех веществ, находящихся в смеси или в растворе
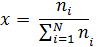
5. Моляльная концентрация, Сm, показывает количество моль растворенного вещества, находящегося в 1 кг растворителя, моль/кг
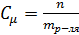 ,
,
Где n – количество моль растворенного вещества,
m р – ля – масса растворителя, кг
Например, для приготовления 0,5 моляльного раствора хлорида магния необходимо 0,5 моль вещества растворить в 1 кг воды
6. Титр раствора, Т – масса вещества в 1 мл раствора, г/мл
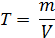
Все концентрации взаимосвязаны друг с другом, значит, зная, например, молярную концентрацию раствора, можно легко получить моляльную или эквивалентную концентрацию раствора.
| Способ выражения содержания р.в. в р-ре | Обозначения и единицы измерения | Математические выражения | Размерности | |
| р.в. | р-ра | |||
| Массовая доля, w | m-масса (г, кг…) | m=100 единиц массы (г, кг…) | 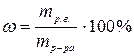 или или 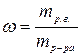 | % - |
| Молярная концентра-ция или молярность, См | nм – число молей | V=1л | 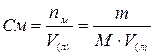 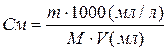 М – молярная масса, г/моль М – молярная масса, г/моль | 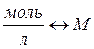 |
| Эквивалентная концен-трация или нормаль-ность Сн, N | nэ-число моль-эквивалентов | V=1л | 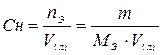 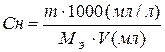 МЭ–молярная масса эквивалента; г/моль-экв. МЭ–молярная масса эквивалента; г/моль-экв. | 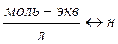 |
| Титр, Т | m-масса, г | V=1мл | 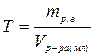 | 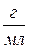 |
Решение задач на переход от одного способа выражения состава раствора к другому основано на использовании математических соотношений между различными единицами измерения компонентов растворов:
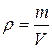
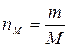
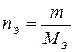
Пример 1
См ® w; Сн ® w
1) Найти массу 1 л раствора (1 л= 1000 мл)
mр-ра = r × V = r × 1000
2) Определить массу растворенного вещества в 1 л раствора
mр.в. = Cм × М × Vр-ра; mр.в. = Cн × Мэ × Vр-ра
Vр-ра = 1л
3) Вычислить массовую долю растворенного вещества
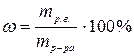
Пример 2
w ® См; w ® Сн
1) Найти массу 1 л раствора (см. пример 1)
2) Определить массу растворенного вещества в 1 л раствора
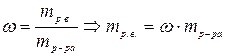
3) Вычислить число молей (моль-экв) растворенного вещества в 1л раствора, т.е. См (Сн):
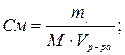
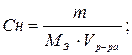
Vр-ра = 1л
Пример 3



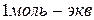
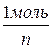

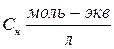
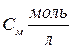 Сн = См × n См =
Сн = См × n См = 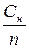
n – число реакционноспособных химических связей в веществе (см. тему «Эквивалент», «Закон эквивалентов»).
Для реакций, протекающих в растворах, состав которых выражен эквивалентной концентрацией, закон эквивалентов можно записать так:
СН,1 × V1 = СН,2 × V2 или N1 × V1 = N2 × V2
V – объем раствора, мл или л;
Сн или N – нормальность раствора.
Это же выражение можно использовать в расчетах по приготовлению разбавленных растворов из более концентрированных и наоборот.
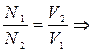 отношение нормальных концентраций растворов обратно
отношение нормальных концентраций растворов обратно
пропорционально отношению их объемов.
Эквивалентная концентрация растворов связана с его титром соотношением:
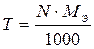
 2015-08-13
2015-08-13 1197
1197
