Классификация
В зависимости от химических свойств различают:
- Солеобразующие оксиды:
- основные оксиды (например, оксид натрия Na2O, оксид меди(II) CuO): оксиды металлов, степень окисления которых I—II;
- кислотные оксиды (например, оксид серы(VI) SO3, оксид азота(IV) NO2): оксиды металлов со степенью окисления V—VII и оксиды неметаллов;
- амфотерные оксиды (например, оксид цинка ZnO, оксид алюминия Al2О3): оксиды металлов со степенью окисления III—IV и исключения (ZnO, BeO, SnO, PbO);
- Несолеобразующие оксиды: оксид углерода(II) СО, оксид азота(I) N2O, оксид азота(II) NO.
Номенклатура
В соответствии с номенклатурой ИЮПАК, оксиды называют словом «оксид», после которого следует наименование химического элемента в родительном падеже, например: Na2O — оксид натрия, Al2O3 — оксид алюминия. Если элемент имеет переменную степень окисления, то в названии оксида указывается его степень окисления римской цифрой в скобках сразу после названия (без пробела). Например, Cu2О — оксид меди(I), CuO — оксид меди(II), FeO — оксид железа(II), Fe2О3 — оксид железа(III), Cl2O7 — оксид хлора(VII).
Часто используют и другие наименования оксидов по числу атомов кислорода: если оксид содержит только один атом кислорода, то его называют монооксидом или моноокисью, если два — диоксидом или двуокисью, если три — то триоксидом или триокисью и т. д. Например: монооксид углерода CO, диоксид углерода СО2, триоксид серы SO3.
Также распространены исторически сложившиеся (тривиальные) названия оксидов, например угарный газ CO, серный ангидрид SO3 и т. д.
В начале XIX века и ранее тугоплавкие, практически не растворимые в воде оксиды химики называли «землями».
2)Оксиды с низшими степенями окисления (субоксиды) иногда по старой русской номенклатуре называют[1] закись (англ. аналог — protoxide) и недокись (например, оксид углерода(II), CO — закись углерода; диоксид триуглерода, C3O2 — недокись углерода[2]; оксид азота(I), N2O — закись азота; оксид меди(I), Cu2O — закись меди). Высшие степени окисления (оксид железа(III), Fe2O3) называют в соответствии с этой номенклатурой окись, а сложные оксиды — закись-окись (Fe3O4 = FeO·Fe2O3 — закись-окись железа, оксид урана(VI)-диурана(V), U3O8 — закись-окись урана). Эта номенклатура, однако, не отличается последовательностью, поэтому такие названия следует рассматривать скорее как традиционные.
Основные оксиды
1. Основный оксид + cильная кислота → соль + вода
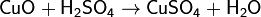
2. Сильноосновный оксид + вода → гидроксид
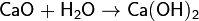
3. Сильноосновный оксид + кислотный оксид → соль
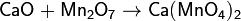
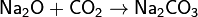
4. Основный оксид + водород → металл + вода
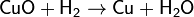
Примечание: металл менее активный, чем алюминий.
 2015-08-13
2015-08-13 1358
1358