Все вещества в природе делятся на простые и сложные. Простые веществасостоят из атомов одного элемента, например S, O2, Cl2, Na, P. Простые вещества разделяют на металлы и неметаллы. Это деление основано на различиях в физических свойствах простых веществ.
В состав сложных веществвходят два или более элемента (например, Н2О, НСl, Н3РО4, Na2CO3). Сложные вещества делятся на органические и неорганические.
Органическимипринято называть соединения углерода (например, СН3СООН - уксусная кислота, С2Н5ОН - этиловый спирт). Простейшие соединения углерода (СО, СO2, Н2СО3 и карбонаты, HCN и цианиды, карбиды и некоторые другие) обычно рассматривают в курсе неорганической химии.
Все остальные вещества называются неорганическими (иногда - минеральными). Неорганические вещества делятся на пять главных классов: оксиды, кислоты, основания, амфотерные гидроксиды и соли. Кислородсодержащие кислоты, основания и амфотерные гидроксиды по своей природе можно объединить в самостоятельный класс гидроксидов.
Оксиды. Оксидаминазываются все соединения, состоящие из кислорода и какого-нибудь элемента. Если элемент образует несколько оксидов, то по числу атомов кислорода, приходящихся на атом элемента, оксиды называются таким образом: СО - монооксид углерода, СO2 - диоксид углерода и т. д.
|
|
|
Некоторым оксидам соответствуют основания, а другим - кислоты. В связи с этим оксиды классифицируются на основные, кислотные и амфотерные.
Основные оксиды - оксиды, гидроксиды которых являются основаниями. Основные оксиды образуются исключительно металлами. Металлы с валентностью меньше IV, как правило, образуют основные оксиды. Только оксиды щелочных и щелочноземельных металлов непосредственно соединяются с водой, образуя растворимые в воде основания - щелочи.
Например: Na2O + H2O = 2NaOH, CaO + H2O = Ca(OH)2.
Большинство же основных оксидов не взаимодействуют с водой; соответствующие им основания получаются косвенным путем и нерастворимы в воде (прил. 3). Все основные оксиды взаимодействуют с кислотами с образованием солей, но не взаимодействуют с основаниями, например:
MgO + H2SO4 ® MgSO4 +H2O
Кислотные оксиды. Это оксиды, гидроксиды которых являются кислотами. Это главным образом оксиды неметаллов (SO3, NO2), хотя некоторые высшие оксиды металлов тоже являются кислотными (СrОз, Мп2О7).
Многие кислотные оксиды непосредственно соединяются с водой, образуя кислоты:
SO3 + H2O ® H2SO4 кислотный гидроксид серы (VI) или серная кислота;
CrO3 + H2O ®H2CrO4 – кислотный гидроксид хрома (VI) или хромовая кислота.
Гидроксиды других кислотных оксидов получают косвенным путем.
Кислотные оксиды иногда называют ангидридамисоответствующих кислот (например, Р2О5 - ангидрид фосфорной кислоты, или просто фосфорный ангидрид).
|
|
|
Главный отличительный признак кислотных оксидов - их способность взаимодействовать с основаниями с образованием солей. Например:
CO2 +2NaOH ® Na2CO3 +H2O.
Кислоты, как правило, не взаимодействуют с кислотными оксидами, кроме окислительно–восстановительных реакций.
Главный отличительный признак кислотных оксидов - их способность взаимодействовать со щелочами и образовывать соли.
Например:
CO2 (оксид углерода(II)) + 2NaOH (гидроксид натрия) = Na2CO3 (карбонат натрия) + H2O
Амфотерные оксиды (Аl2О3, Сr2О3, ZnO и др.)обладают одновременно свойствами кислотных и основных оксидов. Они взаимодействуют с кислотами и щелочами, образуя соли, например:
ZnO (оксид цинка(II)) + 2HCl (соляная кислота) = ZnCl2 (хлорид цинка(II)) + H2O
ZnO (оксид цинка(II)) + 2KOH (гидроксид калия) = K2ZnO2 (цинкат калия(II)) + H2O
Все оксиды рассмотренных групп обладают свойством образовывать соли, поэтому их часто объединяют под общим названием солеобразующих оксидов.
Безразличные оксиды - оксиды, которые ни прямым, ни косвенным путем не образуют гидроксидов и не взаимодействуют ни с кислотами, ни с основаниями (например, NO, СО).
Особую группу оксидов образуют так называемые пероксиды. Это соединения некоторых металлов, которые только формально (по их составу) могут быть отнесены к классу оксидов, а по существу они являются солями пероксида водорода Н2О2 (например, Na2O2 - пероксид натрия, ВаО2 - пероксид бария).
Большинство оксидов непосредственно или косвенным путем образуют с водой соединения, носящие название гидроксидов. Например:
CaO + H2O = Ca(OH)2 – основной гидроксид кальция;
SO2 + H2O = H2SO3 – кислотный гидроксид (IV) серы или сернистая кислота.
При нагревании гидроксиды, кроме гидроксидов щелочных и щелочноземельных металлов, разлагаются на оксид и воду:
Cu(OH)2 (t)® CuO + H2O; H2SO3 (t)® SO2 + H2O
Гидроксиды, в зависимости от их свойств, относят или к классу кислот, или к классу оснований. Кроме того, существуют гидроксиды, обладающие одновременно свойствами и кислот, и оснований. Они называются амфотерными гидроксидами, В соответствии с этим, оксиды и образующиеся гидроксиды, делятся на три группы: кислотные, основные и амфотерные.
Кислоты (кислотные гидроксиды). Соединяясь с водой, оксиды неметаллов образуют вещества, относящиеся к классу кислот. Такие кислоты называются кислородными(например, H2SO4, H2CO3, HNO3) в отличие от бескислородных кислот, не содержащих кислорода (например, HCI, HF).
К классу кислотных гидроксидов относятся гидроксиды некоторых металлов в высшей степени окисления, например:
H2Cr2O7 – дихромовая кислота или кислотный гидроксид Cr (VI), HMnO4 – марганцевая кислота или кислотный гидроксид Mn (VII).
Водные растворы кислот имеют кислый вкус и окрашивают лакмус (прил. 4) и универсальную индикаторную бумагу в красный цвет. По числу атомов водорода в молекуле кислоты, способных замещаться атомами металлов, различают кислоты одноосновные (например, HNO3), двухосновные (например, H2SO4) и трехосновные (например, Н3PО4).
Все кислоты взаимодействуют с основаниями с образованием соли и воды, например:
HNO3 + KOH = KNO3 + H2O, HMnO4 + KOH = KMnO4 + H2O.
Такие реакции называются реакциями нейтрализации.
Основаниями называются гидроксиды типичных металлов, взаимодействующие с кислотами с образованием солей. В состав молекулы любого основания входит атом металла и одна или несколько гидроксидных групп ОН-. Количество гидроксидных групп у основания определяет его кислотность.
Например, NaOH, Mg(OH)2, Bi(OH)3. При действии кислоты с основанием гидроксидная группа OH- замещается кислотным остатком, и таким образом получается соль (реакция нейтрализации), например: NaOH + НСl = NaCl + Н2О
Большинство оснований нерастворимы в воде. Основания, образованные наиболее активными металлами и растворимые в воде, называются щелочами (например, NaOH, КОН). Их растворы мылкие на ощупь и окрашивают лакмусовую бумагу в синий цвет, а фенолфталеин - в розовый (прил. 4)
|
|
|
Амфотерные гидроксиды могут взаимодействовать как с кислотами (подобно основаниям), так и с основаниями (подобно кислотам), образуя в том и другом случае соли.
Примером может служить Zn(OH)2:
Zn(OH)2 + 2HCl = ZnCl2 +2H2O; H2ZnO2 + 2NaOH = Na2ZnO2 +2H2O,
Соли — это продукты замещения атомов водорода в кислотах атомами металла или продукты замещения гидроксогрупп в основаниях кислотными остатками. Например:
Н3РO4 (фосфорная кислота) → К3РO4 (соль - фосфат калия), Fe(OH)2 (основание - гидроксид железа (II)) → Fе2(SO4)3 (соль - сульфат железа (III)).
Формулы и названия солей наиболее распространенных кислот приведены в табл. 2.
Таким образом, молекулы всех солей состоят из кислотных остатков и металла. Большинство солей - твердые кристаллические вещества. Различают три главных вида солей: нормальные, кислые и основные.
Таблица 2. Соли наиболее часто встречающихся кислот
| Название кислоты | Формула | Название соли |
| Азотистая | HNO2 | Нитрит |
| Азотная | HNO3 | Нитрат |
| Борная | H3BO3 | Борит |
| Бромоводородная | HBr | Бромид |
| Двухромовая | H2Cr2O7 | Бихромат |
| Кремневая | H2SiO3 | Силикат |
| Марганцовая | HMnO4 | Перманганат |
| Серная | H2SO4 | Сульфат |
| Сернистая | H2SO3 | Сульфит |
| Сероводородная | H2S | Сульфид |
| Соляная | HCl | Хлорид |
| Тиосерная | H2S2O3 | Тиосульфат |
| Угольная | H2CO3 | Карбонат |
| Уксусная | CH3COOH | Ацетат |
| Фосфорная | H3PO4 | Фосфат |
| Фтороводородная | HF | Фторид |
| Хлорноватая | HClO3 | Хлорат |
| Хлорноватистая | HClO | Гипохлорит |
| Хромовая | H2CrO4 | Хромат |
| Цианистоводородная (синильная) | HCN | Цианид |
| Хлорная | HClO4 | Перхлорат |
Нормальные соли – продукты полного замещения атомов водорода в молекулах кислот на атомы металлов или гидроксидных групп в молекулах оснований на кислотные остатки. Например:
H3PO4 + 3NaOH® Na3PO4 + 3H2O; Cu(OH)2 + 2HNO3® Cu(NO3)2 + 2H2O.
Кислые соли – продукты неполного замещения атомов водорода в кислотах на атомы металлов. Кислые соли содержат в своем составе водород, способный замещаться металлом. Например: KH2PO4 – дигидрофосфат калия, NaHSO4 - гидросульфат натрия. Кислые соли образуются двух или трехосновными кислотами.
|
|
|
Основные соли – продукты неполного замещения гидроксидных групп в основаниях на кислотные остатки. Например, CuOHCl – гидроксохлорид меди (II), (CuOH)2CO3 – гидроксокарбонат меди (II).
Названия кислых и основных солей. Число незамещенных атомов водорода в составе кислой соли обозначается с помощью греческих приставок: два – дигидро; три – тригидро; четыре – тетрагидро и т.п. Например, Ca(H2PO4)2 – дигидрофосфат кальция, MgHPO4 – гидроортофосфат магния. Число незамещенных групп OH- в составе основной соли обозначается аналогично: MgOHCl – гидроксохлорид магния; (BaOH)2SO4 - гидроксосульфат бария; [Al(OH)2]2SO4 –дигидроксосульфат алюминия.
Пример 1. Какие из соединений, формулы которых CaO, H2O, KOH, CuO,HCl, будут реагировать между собой при обычных условиях? Напишите уравнения возможных реакций.
Решение. Определим, к какому классу неорганических соединений относятся вышеприведенные вещества, назовем их:
CaO — оксид кальция (основной оксид);
H2O — вода;
KOH — гидроксид калия (сильное основание щелочь);
CuO — оксид меди(II) (основной оксид);
HCl — хлороводородная кислота, водный раствор - соляная кислота.
Возможные реакции определяем, исходя из свойств соединений. Основные оксиды CaO и CuO реагируют с HCl; CaO реагирует с H2O; основание KOH реагирует с кислотой.
В результате имеем:
CaO + H2O = Ca(OH)2 - гидроксид кальция,
CaO + 2HCl = CaCl2 + H2O - хлорид кальция,
CuO + 2HCl = CuCl2 + H2O - хлорид меди,
KOH + HCl = KCl + H2O - хлорид калия.
Пример 2. Как получить гидроксид бария, исходя из бария, кислорода и воды? Напишите уравнения реакций. Можно ли подобным путем получить гидроксид?
Решение. При обычных условиях барий (активный щелочноземельный металл) реагирует с кислородом воздуха. Полученный оксид бария хорошо растворяется в воде, образуя гидроксид бария:
а) 2Ba + O2 = 2BaO;
б) BaO + H2O = Ba(OH)2.
Марганец при обычных условиях с O2 не реагирует (только при нагревании). Компактный металл покрывается устойчивой оксидной пленкой MnO. Но MnO с водой не реагирует. Поэтому при вышеуказанных условиях Mn(OH)2 получить нельзя.
Пример 3. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
MnO→MnCl2→Mn(OH)2→MnSO4.
Решение. При обычных условиях получим:
а) MnO + 2HCl = MnCl2 + H2O;
б) MnCl2 + 2KOH = Mn(OH)2Ї + 2KCl;
в) Mn(OH)2 + H2SO4 (разб.) = MnSO4 + 2H2O.
Названия исходных веществ и продуктов реакции следующие:
MnO - оксид марганца (II), MnCl2 - хлорид марганца (II), Mn(OH)2 - гидроксид марганца (II), MnSO4 - сульфат марганца, HСl - соляная кислота, KOH - гидроксид калия, KCl - хлорид калия, H2SO4 - серная кислота.
Контрольные вопросы
35. Какие элементы образуют кислотные и основные оксиды? Приведите примеры.
36. Чем отличаются амфотерные оксиды от основных и кислотных оксидов? (Примеры).
37. Каким образом, зная формулу основания, можно определить, является ли оно щелочью? (Примеры).
38. Чем отличаются и что общего в кислородных и бескислородных кислотах. Как определить основность кислоты? (Примеры).
39. Продуктами замещения, каких составных частей кислоты, основания, являются соли? (Примеры).
40. Особенность реакции нейтрализации. (Примеры).
41. Даны формулы веществ: HCI, NiO, CО2, НВr, Н2СrO4, MgCl2, Са3(РO4)2. К какому классу неорганических соединений относится каждое из указанных веществ. Назовите эти вещества. Ответ поясните.
42. Назовите следующие вещества: Na2SО4, H3BO3, CdO, BaSО4, Ti(OH)2, Au(OH)3, NО2. Из перечня веществ выберите соли.
43. Напишите химические формулы следующих веществ: нитрат калия, хромат натрия, кремниевая кислота, соляная кислота, сульфат железа (III), нитрат кальция, оксид мышьяка (III), оксид хлора (I).
44. Какие из нижеприведенных оснований являются растворимыми в воде, а какие - нерастворимыми или малорастворимыми: гидроксид лития, гидроксид титана (IV), гидроксид кальция, гидроксид железа (III), гидроксид никеля (II), гидроксид натрия? Напишите химические формулы этих оснований.
45. Между какими из указанных веществ возможна реакция нейтрализация: NaOH, HNО3, Cu(OH)2, HCl, SО3, FeO, O2? Назовите эти вещества, напишите уравнения возможных реакций нейтрализации. Какие продукты образуются в результате реакций?
46. Каким из указанных оксидов соответствуют основания, а каким - кислоты: MnО, N2О5, Mn2О7, SiО2, CО2, К2О? Ответ поясните. Назовите оксиды и соответствующие гидроксиды.
47. Какие из оксидов, формулы которых CaO, SiО2, CuO, А12О3, СО, К2O, SO3, Fe2O3, будут реагировать с водой при обычных условиях и что при этом образуется? Напишите уравнения возможных реакций.
48. Напишите формулы оксидов, которые могут реагировать: а) только с кислотами; б) только со щелочами; в) как с кислотами, так и со щелочами. Как называются эти три типа оксидов? Напишите уравнения реакций.
49. Как получить гидроксид кальция, исходя из кальция, кислорода и воды? Напишите уравнение реакции. Можно ли подобным путем получить гидроксид меди?
50. Приведите примеры получения оснований прямым действием металла на воду.
51. Гашеную известь, применяемую в строительстве, получают из известняка. Напишите уравнения соответствующих реакций.
52. Произойдет ли химическая реакция, если раствором гидроксида калия подействовать на растворы следующих солей: FeCl3, CuSО4, NaNО3? Укажите, по каким признакам можно узнать, что химическая реакция произошла, напишите уравнения возможных реакций.
53. Как из негашеной извести СаО получить хлорид кальция и нитрат кальция? Напишите уравнения реакций.
54. Напишите формулы оксидов, которые можно получить путем прокаливания кислот следующего состава: Н3ВО3, НВО2, НРОз, Н4Р2О7?
55. Напишите формулы кальциевых солей бромоводородной, угольной и фосфорной кислот. Напишите их названия.
56. Напишите по два примера основной, средней и кислой солей. Дайте им названия.
57. Способны ли оксиды разных элементов реагировать друг с другом? Ответ мотивируйте.
58. При восстановлении водородом оксида марганца (IV), образовался оксид марганца (II). Напишите уравнение реакции.
59. Напишите уравнения реакций образования солей при взаимодействии алюминия с разбавленными растворами соляной и серной кислот.
60. Приведите примеры получения солей взаимодействием двух оксидов и уравнения соответствующих реакций.
61. Как получить сульфат магния, исходя из: а) магния; б) оксида магния; в) гидроксида магния; г) карбоната магния? Напишите уравнения соответствующих реакций.
62. Могут ли находиться совместно в растворе: a) NaOH и НВr; б) Ва(ОН)2 и FeCl3; в) NaCl и КОН? Дайте обоснованный ответ и приведите уравнения соответствующих реакций.
63. Как, исходя из железа и имея все необходимые реактивы, получить гидроксид железа (II)? Напишите уравнения реакций.
64. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
а) 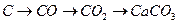
б) 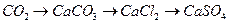
в) 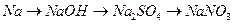
г) 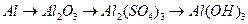
д) 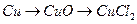
е) 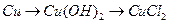
ж) 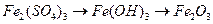
з) 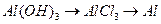
и) 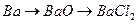
к) 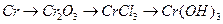
 2015-03-22
2015-03-22 31490
31490
