Проще всего механизм зарождения колебательности объяснить на примере элементарных диссипативных элементов, локализованных в пространстве, то" есть имеющих определенное пространственное распределение, а в случае гетерогенных химических процессов, имеющих также границы или поверхности переноса вещества, например, доставки и отвода реагентов.
В частности, в металлургии примерами гетерогенных химических реакций являются процессы окисления углерода, растворенного в металле на поверхности поднимающихся пузырьков СО (рис. 4.11a)
[ С ]+ [ O ] = { CO }
Окисление углерода из корольков металла, зависающих в шлаке (рис.4.11б)
[ C ]+ [ FeO ] = { CO }+ [ Fe ]
Окисление частичек твердого углерода, окруженных оксидами железа в шлаке (рис. 4.11в) и одновременно восстановление железа и оксида.
CТ + (FeO) = {CO}+ [Fe].
На рис. 4.11 изображена упрощенная схема гетерогенной реакции окисления углерода на границе металл-пузырек. Эту гетерогенную реакцию можно представить состоящей из следующих стадий: доставка кислорода и углерода из объема поверхности пузырька, адсорбция на поверхности, затем элементарный акт химической реакции, десорбция с поверхности внутрь пузырька и, наконец, отвод продукта реакции СО от поверхности внутрь пузырька.
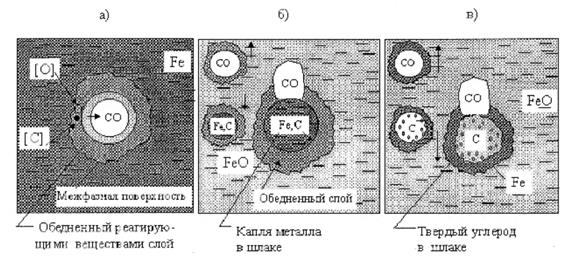
Рис. 4.11. Примеры элементарных осцилляторов в сталеплавильных процессах
 2015-08-13
2015-08-13 578
578








