Рассмотрим окислительно-восстановительное равновесие
aARed + bBOx «aAOx + bBRed,
для которого можно записать полуреакции
aAOx + ne «aARed
bBOx + ne «bBRed,
где n – число электронов, участвующих в ОВ–реакции.
Если компоненты этой системы находятся в химическом равновесии,
то электродные потенциалы полуреакций равны (ЕА = ЕВ). Выразим электродные потенциалы полуреакций из уравнения Нернста, тогда при равновесии
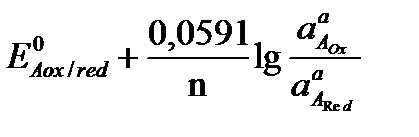
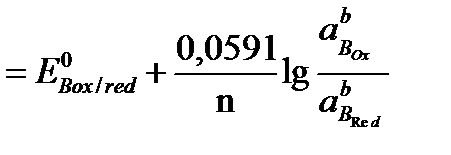 ,
,
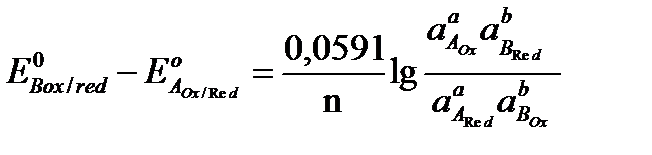 ,
,
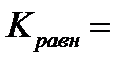
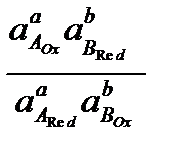 ,
,
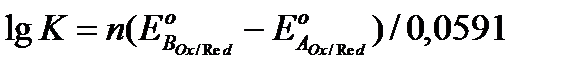 ,
,
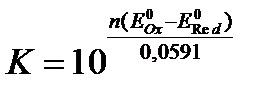 , (27)
, (27)
где n – число электронов, участвующих в ОВ – реакции.
Для аналитических целей используются реакции, которые протекают
на 99,9 %, то есть:
Кравн = 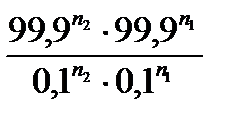 =
= 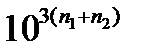 .
.
В случае одноэлектронного перехода, когда n1 = n2 = 1, необходимая минимальная разность потенциалов для протекания реакции на 99,9 % следующая:
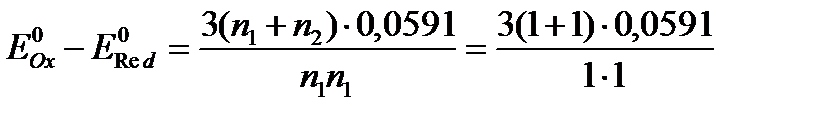 = 0,354В.
= 0,354В.
В методах окислительно-восстановительного титрования в качестве титрантов – окислителей используют растворы брома, йода, солей
церия (IV), перманганата калия (KMnO4), бихромата калия (K2Cr2O7), бромата (BrO3–), йодата (IO3–), в качестве титрантов – восстановителей применяют растворы солей Fe2+,Cr2+, Sn2+,Ti3+, арсенит натрия (NaH2AsO3), оксалат – ион (C2O42-), аскорбиновую кислоту (C6H8O6).
Название окислительно-восстановительного метода титриметрического анализа зависит от названия реагента, используемого в качестве титранта. Классификация методов окислительно-восстановительного титрования
1. Перманганатометрия: титрант KMnO4.
Основное уравнение:
MnO4- +8H+ + 5e = Mn2+ + 4H2O, 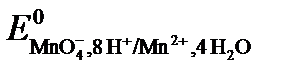 = +1,51 В.
= +1,51 В.
2. Дихроматометрия: титрант K2Cr2O7.
Основное уравнение:
Cr2O72-+14H++6e=2Cr3++7H2O, 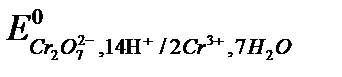 = +1,33 В.
= +1,33 В.
3. Иодометрия: титранты I2, Na2S2O3.
Основные уравнения: I2 +2e «2I-, 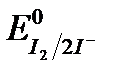 = 0,54 В
= 0,54 В
2S2O32- – 2e «S4O62-, 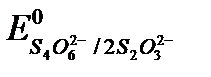 = +0,09 В.
= +0,09 В.
4. Броматометрия: титрант KBrO3.
Основное уравнение: BrO3- +6H+ +6e = Br- +3H2O, 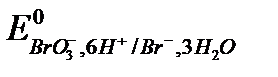 = +1,44 В.
= +1,44 В.
5. Нитритометрия: титрант NaNO2.
Основное уравнение для определения восстановителей:
NO2- + 1e + 2H+ = NO + H2O, 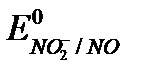 = +1,2 В.
= +1,2 В.
Основное уравнение для определения окислителей:
NO2- – 2e + H2O = NO3- + 2H+, 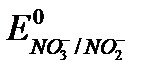 = +0,96 В.
= +0,96 В.
Основное уравнение взаимодействия с первичными аминами:
R-NH2 + NaNO2 + 2HCl ® [R-N+≡N]Cl- + 2H2O + NaCl
Индикация точки эквивалентности
при окислительно-восстановительном титровании
При титровании, основанном на реакциях окисления или восстановления определяемого вещества, изменяется окислительно-восстановительный потенциал системы, наиболее резкое изменение наблюдается вблизи точки эквивалентности.
Окислительно-восстановительными индикаторами являются вещества, которые изменяют окраску при определенном окислительно-восстановительном потенциале, которого система достигает в процессе титрования, подобно тому, как при кислотно-основном титровании пользуются индикаторами, изменяющими окраску при определенном значении рН раствора.
В окислительно-восстановительных методах применяют несколько различных способов индикации точки эквивалентности.
1. Безындикаторное титрование. При этом в конце титрования наблюдается исчезновение или появление окраски, характерное для данного рабочего раствора или для данного определяемого вещества.
К этой группе можно отнести перманганатометрическое титрование,
в котором в качестве титранта используется раствор перманганата калия, являющийся одновременно рабочим раствором и индикатором. После достижения точки эквивалентности избыточная капля титранта придает титруемому раствору отчетливо видимую розовую окраску.
2. Использование специфических реактивов в качестве индикаторов.
В йодметрии (при титровании йодом или тиосульфатом натрия)
в качестве индикатора применяется свежеприготовленный 0,5-ный % раствор крахмала, который с йодом образует адсорбционное соединение интенсивно–синего цвета.
3. Индикаторы, изменяющие окраску в зависимости от окислительно-восстановительного потенциала системы (прил. 7).
Основным достоинством этой группы индикаторов является возможность применения их для различных окислительно-восстановительных методов. Практическое значение имеет лишь небольшое их число. Основные трудности использования связаны с влиянием рН раствора и недостаточной скоростью изменения окраски.
Индикаторы данной группы характеризуются равновесием окисленной формы (IndOx) и восстановленной формы (IndRed), которые имеют различную окраску.
IndOx+ ne «IndRed.
Выражение для окислительно-восстановительного потенциала имеет вид
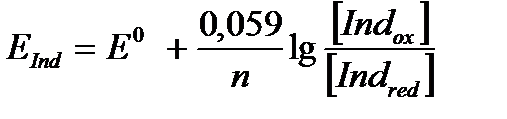
4. Электрохимическая индикация точки эквивалентности. Физико-химические методы анализа: потенциометрическая индикация точки эквивалентности, амперометрическая индикация точки эквивалентности.
 2015-08-13
2015-08-13 5415
5415








