В редоксметрии кривые титрования строят в координатах Е = f (CR),
они иллюстрируют графическое изменение потенциала системы в процессе титрования. До точки эквивалентности потенциал системы рассчитывается по отношению концентраций окисленной и восстановленной форм определяемого вещества (потому что до точки эквивалентности одна из форм титранта практически отсутствует), после точки эквивалентности – по отношению концентраций окисленной и восстановленной форм титранта (потому что после точки эквивалентности определяемое вещество оттитровано практически полностью).
Потенциал в точке эквивалентности определяется по формуле
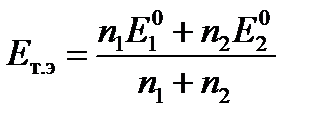 , (26)
, (26)
где 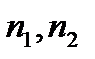 – число электронов, участвующих в полуреакциях;
– число электронов, участвующих в полуреакциях;
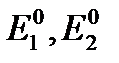 – стандартные электродные потенциалы полуреакций.
– стандартные электродные потенциалы полуреакций.
На рис. 10 представлена кривая титрования раствора щавелевой кислоты H2C2O4 раствором перманганата калия KMnO4 в кислой среде
([H+] = 1 моль/дм3).
Рис. 10. Кривая титрования 100,00 см3 раствора щавелевой
кислоты H2C2O4 с С1/z = 0,1000 моль/дм3 раствором перманганата
калия KMnO4 с С1/z = 0,1000 моль/дм3 при 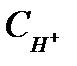 =1 моль/дм3
=1 моль/дм3
Потенциал полуреакции MnO4- + 5 e + 8H+ → Mn2+ + 4H2O зависит от рН среды, так как в полуреакции участвуют ионы водорода.
 2015-08-13
2015-08-13 342
342








