Протекание процесса адсорбции и прочность связывания фермента с носителем в значительной степени зависят от условий проведения иммобилизации. Основными факторами, влияющими на адсорбцию фермента» являются удельная поверхность и пористость носителя, значения рН и ионной силы раствора фермента, его концентрация и температура проведения процесса адсорбции.
Удельная поверхность и пористость носителя. Сорбционная емкость носителя пропорциональна его удельной поверхности. В приложении к белкам (ферментам) эта закономерность, однако, действует только в том случае, когда носитель непористый или когда диаметр пор намного превосходит размер белковых молекул. Если же поры настолько малы, что не могут вместить молекулу фермента, то для белка оказывается доступной только часть общей поверхности, т. е. сорбционнан емкость носителя по отношению к ферменту небольшая, несмотря на очень большую общую удельную поверхность. Критерий для определения оптимального размера пор носителя для адсорбционной иммобилизации ферментов был предложен Р. Мессингом (1976), который изучал адсорбцию различных ферментов на пористом стекле и керамических носителях с калиброванным размером пор. В соответствии с этим критерием диаметр пор должен приблизительно в два раза превосходить размер молекулы белка в направлении ее максимального удлинения- При этом предполагается, что молекулярные размеры субстрата намного меньше, чем фермента, так что молекула субстрата заведомо способна проникнуть в пору, где находится сорбнрован-
ный фермент. В том случае, если субстратом является вещество с очень большой молекулярной массой, выбор диаметра пор носителя может диктоваться уже размерами молекулы субстрата. Более того, высокомолекулярный субстрат сам может служить носителем для иммобилизации фермента. Например, для адсорбционной иммобилизации ферментов целлюлазного комплекса был успешно использован его субстрат — целлюлоза.
Значение рН. Реакция среды оказывает очень сильное влияние на эффективность сорбции фермента на поверхности носителя, особенно, если сорбция осуществляется главным образом за счет электростатических нааимодейстннй. Причина этого влияния состоит в том, что при изменении рН меняется состояние ионизации ионогенных групп носителя и белка, ответственных за связывание. Прн использовании носителей, не являющихся ионообмеЕшиками, максимальная адсорбция обычно достигается в нзоэлектрнческой точке белка. Иными словами, рН-зависимость адсорбции должна иметь вид кривой с одним максимумом, соответствующим значению изоэлектрической точки. Однако известны случаи, когда это правило нарушается. Напри* мер, рН-зависнмость эффективности адсорбции альбумина на латексе имеет вид W-образной кривой, а значение рН, при котором достигается максимальная адсорбция этого белка на угле, изменяется от 3 до 6 в зависимости от типа последнего.
Ионная сила. Значение этой величины оказывает влияние
на прочность связывания фермента с носителем. При высокой
концентрации солей присутствующие в растворе ионы вытесняют
с поверхности носителя связанные за счет электростатических
взаимодействий белковые молекулы. Иными словами» возраста
ние конной силы вызывает десорбцию фермента. Однако иногда
эта закономерность не действует, и увеличение концентрации
соли, наоборот, способствует адсорбции фермента на носителе.
В таких случаях принято говорить об эффекте «высаливания»
белка из раствора. ч-
Коицентрация фермента. При возрастании концентрации фермента в растворе, из которого происходит адсорбция, количество сорбировавшегося на носителе фермента увеличивается и соответственно растет удельная каталитическая активность иммобилизованного препарата. Зависимость удельной каталитической активности от исходной концентрации фермента, как правило, имеет вид кривой с насыщением, что свидетельствует о существовании лишь ограниченного числа центров связывания фермента и а поверхности носителя, которые к тому же обладают неодинаковым сродством по отношению к белку. При дальнейшем повышении концентрации фермента в растворе может происходить образонание поверх первого слоя адсорбированного фермента второго и последующих слоев- Наибольшей каталитической активностью обладают верхние слои адсорбированного фермента, где ограничения, накладываемые на скорость реакции диффузией субстрата, минимальны. Поэтому излишняя
ггрузка» носителя ферментом приводит к тому, что более глубоко расположенные слои адсорбированного биокатализатора исключаются из сферы реакции, и в результате общая эффективность использования фермента снижается.
Температура. Повышение температуры оказывает двоякое воздействие на процесс адсорбционной иммобилизации. С одной стороны, сильное нагревание приводит к потере ферментативной активности вследствие тепловой денатурации белковой глобулы. С другой стороны, рост температуры обычно обеспечивает ускорение процесса благодаря повышению скорости диффузии молекул фермента в порах носителя. Следовательно, должна существовать некоторая оптимальная температура для проведения адсорбционной иммобилизации. Точное значение оптимальной температуры зависит от природы адсорбируемого фермента и поверхности носителя.
Таким образом, эффективность адсорбционной иммобилизации ферментов определяется тонким балансом целого ряда факторов. Нарушение этого баланса вследствие изменения (порой незначительного) какого-либо из внешних условий может привести к резкому ослаблению взаимодействия фермента с носителем и, следовательно, к его десорбции. Чтобы избежать этого нежелательного явления, на практике используется ряд методических приемов, некоторые «з которых рассмотрены в следующем разделе.
§ 5. Способы увеличения эффективности связывания фермента с носителем
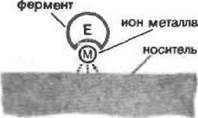
Иммобилизация на предварительно модифицированных носителях. Предварительная модификация носителя во многих случаях позволяет существенно повысить прочность связывания адсорбционно-иммобилнзонанного фермента. Следует подчеркнуть, что помимо увеличения эффективности сорбции модификация носителя нередко обеспечивает также улучшение каталитических свойств иммобилизованного фермента благодаря созданию для его молекул благоприятного микроокружения. Более того, без предварительной модификации носителя иногда вообще не удается сохранить каталитическую активность фермента при адсорбционной иммобилизации. Например, если фермент обладает низкой стабильностью в кислой области рН, то при его адсорбции на силикагеле может произойти потеря каталитической активности, поскольку поверхность этого носителя имеет кислый характер (рН —4), Для предотвращения инактивации фермента силикагель перед проведением иммобилизации необходимо выдержать некоторое время в буферном растворе с таким значением рН, которое является оптимальным для данного фермента. Аналогичная проблема часто возникает при адсорбционной иммобилизации ферментов, которым для нормального функционирования необходимо присутствие в активном центре иона ме-
талла. Дело в том, что большинство носителей способны селективно и прочно сорбировать ионы металлов, поэтому при адсорбционной иммобилизации металлозависимых ферментов может происходить частичная или полная потеря каталитической активности, обусловленная выходом иона металла из активного центра фермента и его связыванием на поверхности носителя, Это нежелательное явление можно устранить, если до проведения иммобилизации обработать носитель избытком раствора, содержащего ионы соответствующего металла, и тем самым насытить центры сорбции ионов металла на носителе.
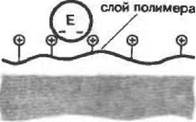
Предварительная обработка носителя ионами металлов применяется также и для повышения прочности связывания ад-сорбционно-иммобилиэованных ферментов. Увеличение эффективности сорбции достигается в этом случае за счет образо вакия комплекса белка с ионами переходных металлов (таких, как Ti, Sn, Zr, Vt Fe)t которые,в свою очередь, прочно связаны с поверхностью носителя (рис. 4,а). Иными словами, ион металла выступает в роли мостика, соединяющего молекулу фермента с носителем. Этот метод дает хорошие результаты при иммобилизации различных ферментов на таких носителях, как, например, целлюлоза, найлон, стекло, фильтровальная бумага и т. д.
Способ, основанный на обработке носителя ионами металлов, может служить хорошей иллк>страцией одного из главных принципов, лежащих в основе применения модифицированных носителей: модификация должна придавать носителю такие свойства, благодаря которым усиливается его способность к связыванию ферм с нтон.
Один из возможных путей достижения этой цели состоит, помимо использования ионов металлов, в обработке носителя веществами, молекулы которых содержат большое число функциональных групп, способных взаимодействовать с группами на поверхности ферментной глобулы за счет электростатических и водородных связен (рис. 4,6). Например, полимеризация на поверхности силохрома акриловой кислоты, винилацетата и т. п. с последующей химической модификацией полимера приводит к образованию носителя, характеризующегося высокой поверхностной концентрацией функциональных групп (гндроксильных, амииоалкильных, аминоарильных и гидразидных). В качестве модификатора часто используется также альбумин, который наносится на носитель путем адсорбции, а затем подвергается денатурации нагреванием. Слой денатурированного альбумина образует на поверх ногти носителя «мягкую» подложку с большим числом функциональных групп, способную прочно связывать молекулы фермента, одновременно обеспечивая для них благоприятное микроокружение. В результате во многих случаях при обработке альбумином удается добиться повышения эффективности сорбции и улучшения каталитических характеристик иммобилизованного фермента.
 |
 |
заряженная
 |
| гидрофобная нотка |
 гидрофильный фврмвкт
гидрофильный фврмвкт
гидрофобный ферменг
Рис. 4. Адсорбционная иммобилизация ферментов на предварительно модифицированных носителях
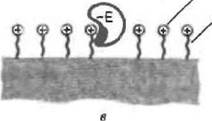
Для повышения эффективности сорбции может быть также использована модификация носителя гидрофобными соединениями. Связывание фермента с такими носителями обеспечивается за счет гидрофобных взаимодействий между модификатором и неполярными участками на поверхности белковой глобулы. При этом способе иммобилизации применяются те же носители, которые используются при гидрофобной хроматографии белков. В первую очередь к ним относятся различные а га розы т ковал ент-ио модифицированные гидрофобными группами (алкильными, феннльными и т. п.). На конце такой гидрофобной «ножки» мо жег присутствовать также и заряженная группа t благодаря чему обеспечивается взаимодействие с ферментом одновременно за счет электростатических и гидрофобных сил (рис. 4, в). При таком «многоточечном» связывании сорбция многих ферментов протекает практически необратимо. Эффект многоточечного связывания достигается также при использовании полисахаридных носителей, модифицированных танином — природным дубящим веществом, содержащим большое число фе-нольных групп. Танин может быть либо адсорбирован на носителе, либо связан с ним химически. Удерживание фермента на
поверхности обработанных танином носителей обеспечивается за счет электростатических, водородных в гидрофобных взаимодействий.
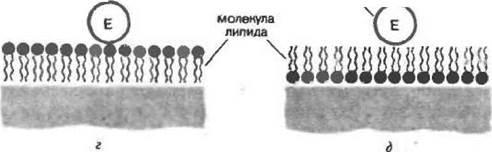
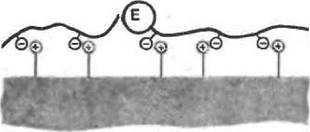
Эффективность сорбции фермента может быть увеличена также при использовании носителей, предварительно модифицированных путем адсорбции монослоя липида (см. гл. 1). Используя носители с той или иной ориентацией липидных молекул в адсорбированном монослое, можно добиться максимальной эффективности сорбции как гидрофильных (рис. 4,г), так и гидрофобных (рис. 4fd) ферментов.
Модификацию носителя иногда проводят путем ковалентной пришивки к его поверхности молекул, ннляющихся- специфическими лигандами иммобилизуемого фермента. Иммобилизация с использованием таких носителей достигается за счет образования прочного нековалентного комплекса между ферментом и связанным с носителем лнгандом. Этот метод иммобилизации, получивший название аффинной сорбции, широко используется в лабораторной практике, например, для избирательного выделения ферментов из сложных смесей (аффинная хроматография).
 |
 |
| Рис. 5. Адсорбционная иммобилизация предварительно модифицирован и ы\ ферментов |
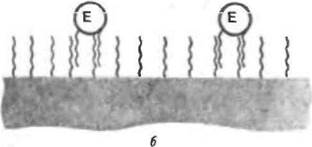
Иммобилизация предварительно модифицированных ферментов. При адсорбционной иммобилизации на ионообменниках часто возникают затруднения, связанные с тем, что для многих ферментов изоэлектрическая точка и рН-оптимум каталитической активности очень близки. Поэтому прочная сорбция наблюдается лишь в областях рН, далеких от изоэлектри-ческой точки, где каталитическая активность мала. Чтобы преодолеть это препятствие, был разработан метод иммобилизации ферментов, предварительно модифицированных введением ионогенных групп {полн-кислоты, карбокснметилцеллюлоза, остатки янтарной кислоты и т.п,). Например, при модификации а-химо-трипсина хлортриазинолым красителем (активным ярко-оранжевым КХ) изоэлектрическая гочка фермента сдвигается в щелочную область. В результате этого модифицированный а-хнмо-трипсин достаточно хорошо сорбируется на многих ионо-обменннках с сохранением
каталитической активности. Другой пример - модификация аосимотрипсина растворимой карбоксн метил целлюлозой* в результате которой он приобретает способность прочно связываться с ДЭАЭ-целлюлоэой и ДЭАЭ-сефадексом при нейтральных значениях рН. Принцип, лежащий в основе этого способа иммобилизации» иллюстрируется схематическим рис. 5, а.
При иммобилизации на гидрофобных носителях эффективность связывания можно увеличить, если промодифицировать молекулу фермента гидрофобными группами (рис. 5,6).
Другие способы увеличения прочности связывания фермента с носителем. Для предотвращения смывания иммобилизованного фермента с носителя часто используют прием, при котором слой адсорбированного фермента обрабатывают бифункциональным сшивающим агентом. В результате на поверхности носителя образуется как бы сплошная пленка из сшитых между собой молекул фермента. В качестве сшивающего агента чаще всего применяется глутаровый альдегид.
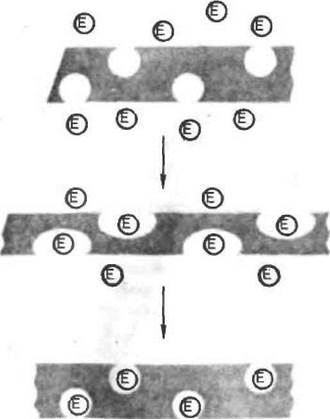
Оригинальный способ, позволяющий существенно повысить количество сорбционно иммобилизованного фермента был предложен К-Мартине ком с сотр. (1976), которые использовали для иммобилизации найлоновые волокна, подвергнутые частичной химической деструкции. Волокна помещают в раствор фермента (рис. 6, а) и подвергают механическому растяжению,
 |
| растягивающее усилие |
Рнс. 6. Иммобилизаций ферментов путем механического захвата в порах иэнлоновой нити при ее растяжении
в результате чего размер пор на их поверхности увеличивается. Молекулы фермента получают благодаря этому возможность проникнуть внутрь пор к там адсорбироваться (рис. 6, б). Через некоторое время растягивающее усилие снимают, волокно сжимается и размер пор возвращается к исходному значению. При этом молекулы фермента, оказавшиеся внутри пор при растяжении волокна, уже не могут покинуть их. Иными словами, происходит механический захват молекул фермента порами носителя (рис. 6, е).
Сравнительно новым методом является электроудерживание, при котором иммобилизация ферментов, осуществляется под действием электрического поля на коллекторах, отделенных от электродов мембранами. 8 качестве коллектора могут использоваться силикагель, ноиообменники, минералы н другие носители. Фермент удерживается на коллекторе за счет электростатических и диполь-дипольных взаимодействий между поляризованными частицами коллектора и молекулами белка. Недостаток этого метода состоит в том, что система должна постоянно находиться под напряжением, поскольку в противном случае фермент будет смываться с носителя.
 2015-08-13
2015-08-13 2704
2704
