3.4.1 Активность ферментов. Одним из основных отличительных свойств ферментов является их очень высокая активность. По силе каталитического действия (активности) ферменты в сотни тысяч раз превосходят обычные катализаторы. Ферменты повышают скорость каталитических реакций в 108…1020 раз.
Для выражения каталитической активности согласно рекомендациям Международного биохимического союза используется катал. Катал (кат) – это каталитическая активность, способная осуществить реакцию со скоростью, равной 1 молю в секунду, в заданной системе измерения активности. В большинстве случаев каталитическая активность выражается в микрокаталах (мккат), нанокаталах (нкат) или пикокаталах (пкат), чему отвечают скорости реакций, выражающиеся в микромолях и пикомолях в секунду.
Одной из важнейших производных величин является удельная каталитическая активность фермента, которую можно выразить в каталах на 1 кг (кат/кг). Другой производной величиной является молярная каталитическая активность, выражаемая в каталах на моль фермента.
3.4.2 Специфичность ферментов. Специфичность (избира-тельность) действия ферментов выражается в их способности катализировать строго определенную реакцию, действовать на определенный субстрат или даже на определенную связь в этом субстрате без образования в итоге побочных продуктов.
Существование определенных ферментов для каждого типа химических реакций, происходящих в клетке, – основной закон биологии. Специфичность ферментов обусловлена наличием в них молекулы белка.
Различают несколько видов специфичности – абсолютную, относительную и стереохимическую.
- Абсолютная специфичность проявляется в том, что фермент действует только на один субстрат, даже на определенную связь в этом субстрате.
Уреаза обладает абсолютной специфичностью к мочевине. Этот фермент катализирует гидролиз мочевины на аммиак и диоксид углерода:
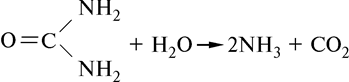
Абсолютной специфичностью обладает каталаза, расщепляющая пероксид водорода на воду и кислород:
H2O2 ® H2O + 1/2 O2
- Относительная групповая специфичность фермента проявляется в том, что он может действовать не на один, а на несколько субстратов, относящихся к одному или нескольким классам органических соединений. Так, фермент пируватдекарбоксилаза катализирует декарбоксилирование пировиноградной кислоты с образованием уксусного альдегида и диоксида углерода. Но этот же фермент декарбоксилирует и другие a-кетокислоты с более длинной углеродной цепочкой, однако скорость реакции с удлинением цепи заметно падает.
- Стереохимической специфичностью. Ферменты действуя только на определенные стереоизомерные формы субстрата.
Специфичность действия ферментов приводит к тому, что превращение веществ в организме происходит строго упорядоченно, определяя путь, по которому идет превращение веществ. Благодаря специфичности фермент направляет реакцию по одному и тому же пути.
3.4.3 Лабильность ферментов. Это зависимость их активности от факторов внешней среды. На скорость ферментативной реакции влияют следующие факторы.
- Влияние температуры. Влияние температуры на действие ферментов проявляется в той же степени, что и на все химические процессы. Повышение температуры на 10 °С согласно правилу Вант-Гоффа увеличивает скорость ферментативной реакции в 2…3 раза. Однако такое ускорение наблюдается в строго определенных температурных пределах – до 40 °С (рис. 7). Оптимальная температура не остается постоянной, с увеличением продолжительности реакции она сдвигается в сторону более низких температур. Такой характер влияния температуры связан с действием двух факторов: с одной стороны, с увеличением температуры возрастает скорость ферментативной реакции, а с другой – происходит инактивация фермента вследствие денатурации белка, что приводит к непрерывному уменьшению концентрации активного фермента.
На процесс инактивации ферментов оказывает влияние содержание воды, так как в высушенном состоянии ферменты более термостабильны. Например, триацилглицерол-липаза сохраняет свою активность в сухих семенах клещевины на 50 % после их прогревания при 120 °С в течение 2 ч.
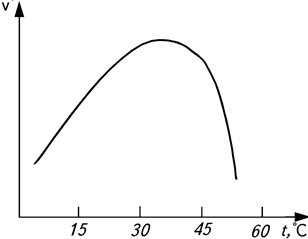
Рис.7. Зависимость скорости υ ферментативной реакции
от температуры t (°C)
Тепловая инактивация ферментов почти всегда является результатом денатурации белка, входящего в состав фермента.
- Влияние кислотности среды (рН). Для каждого фермента характерна определенная область оптимальных значений рН, при которых фермент проявляет максимальную активность (рис. 8).
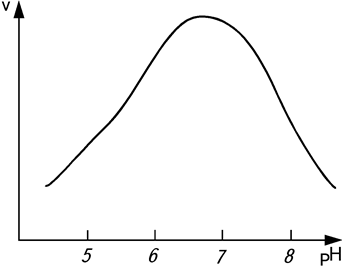
Рис. 8. Зависимость скорости υ ферментативной реакции от рН cреды
Влияние рН среды на действие ферментов основано на том, что происходит изменение заряда белка различных групп в активном центре фермента, вызывающее существенное изменение конформации полипептидной цепи. Для каждого фермента известен оптимум рН, при котором его каталитическая активность максимальна. Ферменты наиболее активны в относительно узком пределе колебаний рН. Большинство растительных ферментов имеет оптимум в пределах физиологических значений рН – 4,0…7,0 (α-амилаза более чувствительна к подкислению).
- Влияние ингибиторов и активаторов. Действие большинства ферментов зависит от наличия ряда веществ, приводящих к инактивации ферментов. Эти вещества получили название ингибиторов.
Ингибиторы бывают общего действия и специфические. Ингибиторы общего действия действуют на белковую часть фермента, а специфические – блокируют активный центр фрмента.
Ингибиторы подразделяют на обратимые и необратимые. Необратимые ингибиторы связывают или разрушают функциональные группы молекулы фермента, необходимые для проявления его каталитической активности, при этом активность фермента не восстанавливается даже в том случае, если ингибитор удаляется каким-либо способом.
Участок молекулы фермента, к которому присоединяется ингибитор, вызывающий изменение конформации фермента, называется аллостерическим центром, а соответствующие ферменты – аллостерическими (от греческого слова «аллос» – другой). Вещества, которые присоединяются к аллостерическому центру, называются эффекторами.
Активаторами называются вещества, которые увеличивают скорость ферментативных реакций. К ним относятся ионы некоторых металлов. Для активирования цитохромоксидазы, каталазы, пероксидазы необходимы ионы железа, полифенолоксидазы – ионы меди, гексокиназы – ионы магния и т. д. К активаторам относятся также органические вещества, содержащие амино- и сульфгидрильные группы.
 2014-02-09
2014-02-09 12207
12207
