Видно, что вклад диффузии учитывается фактором F
| с |
| al |
2 cosh of -- I
 .каж
.каж
Таким образом, роль внутриднффузионных ограннчений в кинетике реакций, катализируемых иммобилизованными ферментами, сводится к увеличению кажущейся константы Мкхаэлнса.
При выводе уравнений для рассмотренных систем делалось допущение, что частицы носителя с иммобилизованным ферментом представляют собой плоские мембраны. Однако в общем случае форма частиц может быть иной — сферической, цилиндрической, неправильной. Решение задачи в случае частиц носителя произвольной формы приводит к следующему выражению для на блюда- 106
| 1.0 |
| 80/ |
| Рис. 17. Вид зависимости фактора эффективности (F) ферментативной pea мши от al: а — параметр, определяемый кинетическими и диффузионными характеристиками системы с им-мобилизованным ферментом; (— толщина мембраны |
емои скорости фермента
тивной реакции, контро
лируемой диффузией:
уиай1 = ijt»T где v — ско
рость реакции в отсутст
вие диффузионных огра
ничений; tj — фактор эф- °'6
фективности, который за
висит от параметра Ф%
называемого модулем Ти
ле- Хотя конкретный вид
функции ц {Ф) зависит
от формы частицы и по
рядка реакции по суб
страту, но очень часто
описывается кривой, ана
логичной виду зависи
мости F от Ы (рис. 17).
Таким образом параметр
J, характеризующий внутреннюю диффузию в плоской мембране, является частным случаем модуля Тиле. Для оценки роли внутренней диффузии в конкретной системе с иммобилизованным ферментом в принципе необходимо вычислить модуль Тиле Ф к, основываясь на рис. 17, сравнить соответствующее значение ц с единицей.
Способы различия внутридиффузионных и внешнедиффузион-ных ограничений. Существует два основных экспериментальных критерия, по которым можно определить, протекает ли реакция, катализируемая иммобилизованным ферментом, во внутридиффу-зиоином или внешнедиффузнонном режиме. Онн основаны на различной чувствительности кинетических параметров ферментативных процессов, контролируемых внешней и внутренней диффузией субстрата, к действию специфических лнгандов и температуры. Для внутриднффузионно-контролируемых реакций прн очень больших значениях а/, когда F <С 1, т. е. ферментативная реакция существенно замедлена диффузией, имеем /См, каж Э> [S]o- В этом случае для общей скорости ферментативной реакции, отнесенной к объему носителя, справедливо выражение

 Видно, что скорость реакции пропорциональна квадратному корню из концентрации фермента и его активности (kKb1l). Эта ситуация существенно отличается от случая внешнедиффузионных ограни-чений, когда скорость реакции в диффузионной области не зависит от каталитических свойств фермента. В частности, ферментативные реакции, контролируемые внутренней диффузией, «чувствуют» эффекты ингибирования, рН-завнсимость активности и т. п.
Видно, что скорость реакции пропорциональна квадратному корню из концентрации фермента и его активности (kKb1l). Эта ситуация существенно отличается от случая внешнедиффузионных ограни-чений, когда скорость реакции в диффузионной области не зависит от каталитических свойств фермента. В частности, ферментативные реакции, контролируемые внутренней диффузией, «чувствуют» эффекты ингибирования, рН-завнсимость активности и т. п.
Как было отмечено выше, температурные зависимости реакций.
контролируемых внешнедиффузионными ограничениями, целиком определяются чувствительностью к температуре коэффициента диффузии D (энергии активации порядка 15—20 кДж/моль). Иная ситуация реализуется для процессов, контролируемых внут-ридиффузнонными ограничениями. Здесь кажущееся значение энергии акт ивации за висит от температурного хода как кинетического (/Л^т/Км.клж) и диффузионного параметров, так и коэффициента распределения Р субстрата между раствором и фазой носителя [уравнение (12)1 и> ка«правило, характеризуется более высокими численными значениями (больше 40 кДж/моль).
Стерические ограничения в катализе иммобилизованными ферментами. Пространственная сетка матрицы, в которой иммобилизован фермент, может препятствовать продвижению молекул субстрата, например, в силу чисто механических причин. В результате активные центры части ферментных молекул оказываются недоступными для субстрата. Фактически это означает снижение концентрации активного фермента и приводит к уменьшению наблюдаемой скорости ферментативной реакции. Следовательно, хотя истинные каталитические параметры и не изменились, фермент не может полностью проявить свою потенциальную активность.
Уменьшение каталитической активности фермента за счет сте-рическнх факторов проявляется особенно часто в случае высокомолекулярных субстратов. Поэтому при создании биокатализаторов» действующих на белки» нуклеиновые кислоты и другие природные биополимеры, предпочтительнее иммобилизовать ферменты на водорастворимых носителях с небольшой молекулярной массой. Стерическне ограничения иногда удается уменьшить или даже полностью устранить путем деградации носителей под действием химических реагентов (мягкой обработкой окислителями, кислотами н т. п.) или специальными ферментами {декстраназой, цел-люлазой н др.). При этом важно, чтобы такая обработка не затронула первичную структуру и ие нарушила пространственную организацию ферментов, пришитых к носителю.
рН-Эффекты в катализе иммобилизованными ферментами. Из ферментативной кинетики хорошо известно, что скорости реакций с участием ферментов в гомогенном растворе сильно зависят от значения рН. Это обусловлено тем, что в катализе участвуют функциональные группы белка, способные протонироваться или депро-тонироваться в зависимости от рН в растворе, а реакционноспо-собной является» как правило, только одна из форм.
В принципе рН-эффекты в катализе иммобилизованными ферментами описываются теми же закономерностями, которые были рассмотрены при анализе распределения субстрата. Однако ионы Н"1" и ОН"~ относятся к числу наиболее обших эффекторов ферментативной активности, поэтому вопрос о влиянии их распределения и диффузии на кинетику действия гетерогенных биокатализаторов необходимо рассмотреть отдельно.
1. Распределение протонов- В качестве примера рассмотрим
 |
| Активность, ЮОг |
 6
6
ТО рН
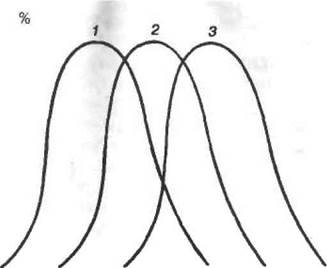
Рис.!8. Гипотетические рН-зависимости каталитической активности свободного (ней н мобилизованного) фермента (кривая 2), иммобилизованного из поликатионном (кривая J), полианионном (кривая 3) носителях
фермент, иммобилизованный на гшлиэлектролнтном носителе. Пусть для определенности оптимум действия фермента в гомогенном растворе наблюдается при рН 8, а кривая зависимости активности от рН имеет колоколообразный вид (кривая 2 на рис. 18). Если для работы с иммобилизованным ферментом значение рН во внешнем растворе выбрать равным 8, то из-за эффекта распределения протонов внутри полиэлектролитной матрицы оно будет другим. Так» если фермент иммобилизован на полнанионном носителе, то внутри него концентрация протонов выше, чем во внешием растворе (сдвиг в сторону более кислых значений рН); обратная картина имеет место в случае поликатионного носителя. Это приведет к тому, что фермент» иммобилизованный как на поликатнон-ном (кривая / на рис. 18)т так н на лолианионном (кривая 3 на рис. 18) носителе, будет работать не с полной эффективностью, хотя значение рН во внешнем растворе соответствуюет оптимуму его каталитической активности.
Подобные изменения рН~зависимостн ферментативной активности часто наблюдаются в реальных системах. Они целиком обусловлены присутствием на полиэлектролитном носителе заряженных групп. Добавление в систему с иммобилизованным ферментом высококонцентрированных растворов солей или буферных систем вызывает экранирование зарядов групп носителя и, следовательно, уменьшение сдвигов рНчэптимумов активности. Иными словами, сдвиг рН-зависимостей активности иммобилизованных ферментов, обусловленный распределением протонов, наблюдается только в разбавленных буферных растворах с низкой ионной си-лой. С другой стороны, зависимость сдвига рН-оптимума активности от ионной силы служит серьезным указанием на то, что распределение протонов между раствором и носителем играет
важную роль в катализе иммобилизованным препаратом фермента,
2. Ограничение диффузии протонов. Полимерный носитель, на котором иммобилизован фермент, может препятствовать свободной диффузии протонов внутри частицы носителя. Это связано с тем, что внутри частицы носителя существенно заторможена диффузий протонов по механизму, характерному для гомогенного раствора. Поскольку концентрация протонов в системе обычно мала (10~7 моль/л или ниже), то даже небольшой избыток (или, наоборот, дефицит), обусловленный торможением диффузии, может вызвать заметное изменение рН внутри частицы. Это, в свою очередь, приведет к существенному изменению рН-зави си мости каталитической активности, особенно для т,ех ферментативных реакций, и которых протоны являются субстратом или продуктом (как( например, при действии гидролаз, дегндро-геназ, киназ и некоторых других ферментов).
Пусть, например, фермент, иммобилизованный на носителе, катализирует реакцию» сопровождающуюся образованием протонов, в отсутствие буферного раствора. После начала реакции в матрице начинают накапливаться протоны, что приводит к появлению градиента концентрации протонов и последующей их диффузии ня частицы во внешний раствор. Однако если диффузия заторможена, то протоны накапливаются внутри частицы и вызывают уменьшение рН в микроокружении фермента. Это, в свою очередь, влияет на скорость ферментативной реакции, а значит, и на скорость выделения протонов — продукта ферментативной реакции. Если рН внутри частицы до начала реакции выше рН-оптимума фермента, то образующиеся в ходе реакции протоны снижают рН, повышая тем самым скорость ферментативной реакции, т. е. скорость выделения протонов. В результате значение рН частицы уменьшается еще сильнее, а скорость ферментативной реакции еще больше нозрастает. Иными словами, в такой системе будет наблюдаться явление автокатализа. Окончательно стационарное состояние будет достигнуто только тогда, когда значительное повышение концентрации протонов будет оказывать лишь незначительное влияние на скорость фермента-тивной реакции*.
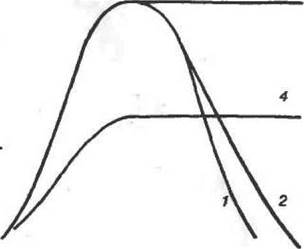
Если значение рН начала реакции ниже рН-оптимума активности, то по мере выделения протонов в ходе ферментативной реакции рН уменьшается еще сильнее и реакция замедляется. На графике рН-зависимости относительной ферментативной активности (рис. 19) это отразится следующим образом: ветви кривой, соответствующие низким значениям рН для иммобилизованного и нативного ферментов, практически совпадут, а «щелочная» ветвь кривой (выше рН-оптимума активности) в случае иммобилизованного фермента существенно расширится (сравни
 ВОЗМОЖНЫ CHiy*JH,HH, КО) Да CTdtUHHltipilOe СОСТОЯНИС |1С ДОСТИГАЕТСЯ
ВОЗМОЖНЫ CHiy*JH,HH, КО) Да CTdtUHHltipilOe СОСТОЯНИС |1С ДОСТИГАЕТСЯ
I1 itum случае нзблкмикпия ko.il-б:ш" i- i процессы; и инк p"'ii т*йяп нщку НО
кривые 1 и 2). причем до та- Аит»«стк% кой степени, что может пре- юо вратиться ь плато (кривая 3). В предельном случае, когда иммобилизованный фермент работает при рН ниже значения рН оптимальной активности, рН-зависимость активности может трансформироваться к виду (кривая 4), т. е. с достижением плато. Чем существеннее диффузионные ограничения протонов в носителе и чем выше активность иммобилизованного фермента, тем ниже будет высота плато на кривой 4. Если в ходе реакции происходит поглощение протонов, то будут наблюдаться обратные явления.
Таким образом, если в экслериме нте н аб л юд аютс я рН-зависимостн активности, аналогичные тем, что приведены на рис. 19t то это указывает на ограничения диффузии протонов в системе с иммобилизованным ферментом.
Ускорение диффузии протонов в присутствии буферных растворов. Если система с иммобилизованным ферментом {подобная той, что была описана в конце предыдущего раздела)
 |
| РН |
| Рис. 19. Изменение рН-нрофидей активности иммобилизованного фермента в результате ограничения диффузии протонов е частицах носителя. Крмная / — свободный (не иммобилизован mlihJ фермент в растворе; кривая 2 - иммоСн лиэованн^й фермент пря слабых ограничениях в диффузии протонов; кривые 3 и 4 —■ нкмо-были зова нный фермент ло мере усиления огра- ti В ДИффуЭНН HfJOTDHQU |
 |
| РАСТВОР |
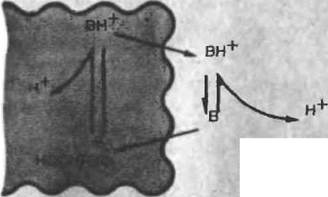
Рис 20. Схематическое изображение процесса переноса притонов компонентами буферного раствора в системе с иммобилизованным ферментом
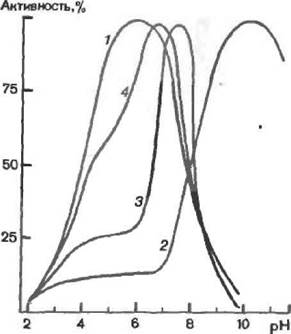
Рис. 21. Влияние буферной системы, ускоряющей перенос протонов в системе с иммобилизованным ферментом, ни вид рН-зависимости его каталитической активности
Кривая 1 — свободный (не и м мобилизованный) фермент в растворе; крннпя 2 -нымобилнзр ванный фермент при значительных ограничения1; в диффузии протонов: кривые 3 и 4 — иммобилизованный ферм«кт по мере снятий ограничении % диффузии протонов увеличивающимися концентрациями буферного раствора
работает в присутствии компонентов буферного раствора, то они, связывая образующиеся в ходе реакции протоны, могут переносить их, удалять из микроокружения фермента. Обусловлено это тем, что на границе раздела частица носителя/ /раствор создается градиент концентрации протонироваиной формы основной компоненты буферного раствора (ВН+). Это приведет к диффузии формы ВН+ в свободный раствор, где за счет более высокого значения рН она продиссоци-ирует с высвобождением свободной формы В, которая, в свою очередь, будет диффундировать по градиенту концентрации в частицу носителя (см. рис. 20). В системе, где свободная диффузи» протонов сильно ограничена (кривая 2 на рис. 21), добавление буферного раствора может привести к смещению плато в сторону более высоких значении активности и к появлению S-образ-ного характера у
ветви рН-зависимости (см. кривые 3, 4 на рис.
Таким образом, добавление буферных растворов в систему с иммобилизованным ферментом может «снимать» ограничения в диффузии протонов и приводить к увеличению ферментативной активности в области некоторых значений рН.
Сочетание эффектов распределения и диффузии протонов. Если в системе с иммобилизованным ферментом одновременно имеют место эффекты распределения протонов и ограничения их диффузии, то заранее трудно предсказать вид рН-зависи-мостн активности. Оба этих фактора могут действовать взаимосогласованно: либо как синергисты (т.е. усиливать друг друга), либо как антагонисты (ослаблять действие друг друга). Возможно несколько различных вариантов: фермент иммобилизован на полианионном, поликатионном или нейтральном носителе, и катализируемая им реакция протекает с выделением или поглощением протонов, либо вообше не сопровождается изменением их концентрации. Здесь не будут рассмотрены все эти возможные варианты. Отметим, что только дли фермента, иммобилизованного на электронейтральном носителе и катализирующего процесс,
не сопровождающийся изменением концентрации протонов, не должно наблюдаться изменений рН-зависимости активности. Но даже в такой системе вид кривой зависимости активности фермента от рН может измениться, если лимитирующей стадией реакции является диффузия субстрата.
Эффекты ингибированкя и активации в катализе иммобилизованными ферментами. Полимерный носитель может вносить свою специфику и в действие таких регуляторов ферментативной активности, как ингибиторы и активаторы.
Низкомолекулярные ингибиторы и активаторы. Влияние и из ко -молекуляриого ингибитора на фермент определяется, в основном, распределением молекул ингибитора между фазой носителя и раствором. Диффузионные ограничения, как правило, не изменяют характер ингибирования фермента после достижения стационарного СОСТОЯНИЙ.
Наиболее прост для анализа тот случай, когда носитель не накладывает ограничения на диффузию субстрата и характер ингибирования целиком определяется распределением субстрата и ингибитора между матрицей и раствором. Если ингибитор и полимерный носитель одноименно заряжены, то степень ингибирования снижается {по сравнению с ситуацией в гомогенном растворе), а если они несут на себе заряды противоположного знака, то степень ингибирования возрастает. Если в последнем случае субстрат имеет одинаковый заряд с носителем, то степень ингибирования еще более увеличивается. В данном изложении не будут рассмотрены конкретные примеры: случаи конкурентного и неконкурентного ннгибирования, ингибирования продуктом реакции и т. п. Читатель ножет это проделать сам в качестве упражнения и вывести соответствующие математические выражения. Анализ этих систем показывает, что во всех случаях кинетика действия иммобилизованных ферментов, осложненная ингибированием, описывается уравнением Миха-элнеа — Ментен.
Несколько более сложную задачу представляет описание ингибирования при наличии диффузионных ограничений для субстрата. Можно показать, что при очень сильном ограничении диффузии субстрата иммобилизованный фермент может вообще не реагировать на добавление ингибитора, и скорость реакции определяется скоростью диффузии субстрата. При достаточно высоких концентрэцих субстрата процесс может перейти в кинетическую область и присутствие ингибитора становится заметным. Если же диффузия субстрата ограничена незначительно, то ингибитор будет подавлять активность иммобилизованного фермента. В промежуточных случаях степень ингибировання фермента постепенно снижается по мере того, как повышается уровень ограничений в диффузии субстрата.
Высокомолекулярные ингибиторы. Активность некоторых нто15 in vivo, в первую очередь протеаз, регулируется ингибиторами белковой природы с молекулярными массами
около 10 000 и выше. Естественно, их действие на иммобилизованные ферменты может осложняться как диффузионными ограничениями, так и стерическими затруднениями. Оба этих эффекта будут препятствовать контакту молекулы ингибитора с ферментом и тем самым уменьшать эффективность ингибиро-взния.
Ингибирование продуктом реакции. Все рассмотренные соображения справедливы и для этого частного случая ингибиро-ваиия. Однако при ограничении диффузии продукта не может быть справедливым допущение о равномерном распределении ингибитора в фазах свободного раствора и носителя. Проанализируем, к каким кинетическим последствиям может привести этот фактор.
Во-первых, концентрация продукта-ингибитора а микроокру~ жении фермента должна быть существенно выше, чем н свободном растворе. Следовательно, иммобилизованный фермент может заметно ингибироваться даже тогда, когда концентрация продукта во внешнем растворе мала. Во-вторых, в случае внутри-диффузионных ограничений продукта концентрация субстрата будет убывать по направлению к центру частицы, а концентрация продукта будет увеличиваться в том же направлении. Иными словами, степень ингмбирования иммобилизованного фермента, находящегося в глубине частицы носителя, будет существенно выше, чем на границе раздела с внешним раствором.
В зависимости от того, ло какому- механизму происходит ингибирование продуктом, изменяется потенциально достижимое значение максимальной скорости ферментативной реакции V. Если продукт — конкурентный ингибитор, то при высоких концентрациях субстрата удается преодолеть и ограничение диффузии, и ннгибирование продуктом (т, е. достичь значения V в отсутствие ингибирования). В случае неконкурентного ннгибирования продуктом оптимальное значение скорости реакции {в условиях насыщения фермента субстратом) никогда не достигнет значения V. Чем эффективнее носитель препятствует свободной диффузии, тем более существенные различия в этих значениях будут наблюдаться.
 2015-08-13
2015-08-13 781
781








