При высокой концентрации субстрата – скорость максимальна
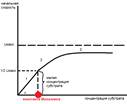 Константа Михаэлиса (Кмих) – концентрация субстрата, при которой скорость реакции = ½ (половина) скорости максимальной.
Константа Михаэлиса (Кмих) – концентрация субстрата, при которой скорость реакции = ½ (половина) скорости максимальной.
Кмих отражает сродствофермента и субстрата (Кмих маленькая => сродствовыше)
Каждый фермент имеет свою Кмих.
Кмих характеризует каталитическую активность фермента => чем меньше Кмих, тем активнее фермент.
| Быстрая | Медленная (на уровне: включение/выключение генов) |
| Изменение рН, температуры | Изменение скорости биосинтеза белка-фермента |
Типы регуляции:
· Ковалентная модификация
· Аллостерическая регуляция
Уровни регуляции:
1. Свойства окружающей среды
2. Аллостерическая регуляция
3. Изменение активности синтеза
4. Влияние гормонов на ферментативный аппарат клетки
| Заместительная -использование ферментов в случае их недостаточности (не хватает фермента => можно добавить) | Патогенетическая - применение ферментов в сочетании с другой терапией |
| · эффективна при желудочно-кишечных заболеваниях, связанных с недостаточностью секреции пищеварительных соков Например, пепсин используют при ахилии, гипо- и анацидных гастритах. · Дефицит панкреатических ферментов может быть компенсирован приёмом внутрь препаратов, содержащих основные ферменты поджелудочной железы (фестал, энзистал, мезим-форте и др.) | Протеолитические ферменты (трипсин, химотрипсин): для обработки гнойных ран с целью расщепления белков погибших клеток, для удаления сгустков крови или вязких секретов при воспалительных заболеваниях дыхательных путей Гиалуронидаза: для рассасывания коллоидных рубцов, спаек Ряд ферментов для лечения опухолей (аспарагиназа для лечения лейкозов) Коллагеназа ДНК-аза: лечение вирусных заболеваний глаз Препараты фибринолизина, стрептолиазы, стрептодеказы, урокиназы: при тромбозах и тромбоэмболиях |
| Первая (небольшая группа) | Вторая (большая группа) |
| ферменты активно секретируется в плазму крови определёнными органами | ферментов, высвобождающихся из клеток во время их нормального функционирования. ферменты выполняют свою функцию внутри клетки и не имеют физиологического значения в плазме крови |
| Например, печень синтезирует неактивные предшественники ферментов свёртывающей системы крови | У здорового человека активность этих ферментов в плазме низкая и достаточно постоянная, так как постоянно соотношение скоростей высвобождения их из клеток и скоростей разрушения. |
При многих заболеваниях происходит повреждение клеток, и их содержимое, в том числе и ферменты, высвобождаются в кровь.
К причинам, вызывающим высвобождение внутриклеточного содержимого в кровь, относят нарушение проницаемости мембраны клеток (при воспалительных процессах) или нарушение целостности клеток (при некрозе).
Уровень активности ферментов в плазме коррелирует со степенью повреждения клеток.
Для энзимодиагностики имеют большое значение знания о субклеточной локализации ферментов.
| воспалительный процесс | глубокие повреждениях клетки, некроз |
| появление в плазме крови ферментов, имеющих только цитозольную локализацию | при обнаружении митохондриальных или ядерных ферментов |
Изоферменты - ферменты, катализирующие одну и ту же химическую реакцию, но отличающиеся по первичной структуре белк.
Они катализируют один и тот же тип реакции с принципиально одинаковым механизмом, но отличаются друг от друга кинетическими параметрами, условиями активации, особенностями связи апофермента и кофермента.
Природа появления изоферментов разнообразна, но чаще всего обусловлена различиями в структуре генов, кодирующих эти изоферменты. Следовательно, изоферменты различаются по первичной структуре белковой молекулы и, соответственно, по физико-химическим свойствам. На различиях в физико-химических свойствах основаны методы определения изоферментов.
По своей структуре изоферменты в основном являются олигомерными белками. Причём та или иная ткань преимущественно синтезирует определённые виды протомеров. В результате определённой комбинации этих протомеров формируются ферменты с различной структурой - изомерные формы. Обнаружение определённых изоферментных форм ферментов позволяет использовать их для диагностики заболеваний.
Изоформы лактатдегидрогеназы.
Фермент лак-татдегидрогеназа (ЛДГ) катализирует обратимую реакцию окисления лактата (молочной кислоты) до пирувата (пировиноградной кислоты)
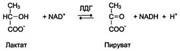
ЛДГ (лактатдигидрогеназа) - олигомерный белок, состоящий из 4 субъединиц 2 типов
Типы: Н – сердце (heart), М – мышца (muscle)
| Лактат | ЛДГ 1 – утилизация | ЛДГ 5 катализирует образование |
| В сердце и почках | ЛДГ 1 (т.к. аэробный обмен пируват быстро окисляется до СО2 и Н2О) | ЛДГ 2 |
| В мышцах и печени | ЛДГ 5 (т.к. глюкозный обмен пируват восстанавливается до молочной кислоты) | ЛДГ 4 |
| В крови (в норме) | ЛДГ 2 | |
| В крови (при паталогии) | ЛДГ 1 – при инфаркте миокарда | ЛДГ 5 и ЛДГ 4 – при гепатите |
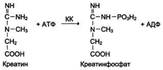
Изоформы креатинкиназы.
Креатинкиназа (КК) катализирует реакцию образования креатинфосфата:
|
|

 2015-08-13
2015-08-13 619
619







