Основные этапы ферментативного катализа
Этап.
Ориентировочная сорбция субстрата на активном центре фермента с образованием обратимого E-S комплекса (фермент-субстратного). На этом этапе происходит взаимодействие адсорбционного центра фермента с молекулой субстрата. При этом и субстрат подвергается конформационной перестройке. Все это происходит за счет возникновения слабых типов связей между субстратом и адсорбционным центром фермента. В результате этого молекула субстрата подается на каталитический центр в наиболее удобном для него положении. Этот этап является легко обратимым, потому что здесь участвуют только слабые типы связей. Кинетическая характеристика 1-го этапа ферментативного катализа - константа Михаэлиса (Км).
Этап.
Химические превращения молекулы субстрата в составе фермент-субстратного комплекса с образованием комплекса фермента с химически преобразованным субстратом. На этом этапе разрываются одни ковалентные связи и возникают новые. Поэтому этот этап протекает значительно медленнее, чем 1-й и 3-й этапы. Именно скорость второго этапа определяет скорость всей ферментативной реакции в целом. Значит, скорость ферментативного процесса в целом характеризуется величиной k+2, которая является почти всегда самой маленькой из всех частных констант скоростей. Кинетическая характеристика 2-го этапа - максимальная скорость (Vmax).
Этап.
Десорбция готового продукта из его комплекса с ферментом. Этот этап протекает легче, чем 2-й. Он, как и 2-й этап, тоже необратим. Исключение - обратимые ферментативные реакции.
Кинетика изучает влияние разных факторов на скорость реакции. Скорость ферментативной реак ции (У) измеряют по убыли субстрата или приросту продукта за единицу времени.
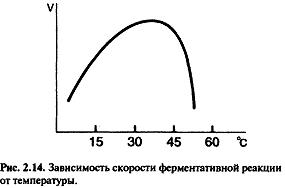
При повышении температуры на каждые 10 °С скорость реакции увеличивается примерно вдвое (правило Вант-Гоффа).
При высоких температурах разрушаются слабые межрадикальные связи, изменяется конформация фермента, т.е. происходит денатурация. Денатурация означает уменьшение количества активного фермен та, соответственно снижается и скорость реакции.
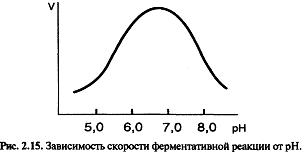 Оптимум рН для большинства ферментов находится между 5,0 и 9,0.
Оптимум рН для большинства ферментов находится между 5,0 и 9,0.
Колоколобразная форма кривой означает, что суще ствует некоторое оптимальное состояние ионизации фермента и субстрата, обеспечивающее наилучшее со единение фермента с субстратом и катализ реакции.
От рН зависят:
- ионизация аминокислотных остатков, включенных в катализ;
- ионизация субстрата;
- конформация фермента и его активного центра.
__
Уравнение Михаэлиса-Ментена
Уравне́ние Михаэ́лиса — Ме́нтен — основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата и фермента. Простейшая кинетическая схема, для которой справедливо уравнение Михаэлиса:
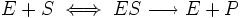
Уравнение имеет вид:
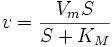 ,
,
где
§ 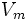 — максимальная скорость реакции, равная
— максимальная скорость реакции, равная 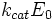 ;
;
§ 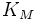 — константа Михаэлиса, равная концентрации субстрата, при которой скорость реакции составляет половину от максимальной;
— константа Михаэлиса, равная концентрации субстрата, при которой скорость реакции составляет половину от максимальной;
§ 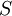 — концентрация субстрата.
— концентрация субстрата.
Вывод уравнения
Вывод уравнения был впервые предложен Бриггсом и Холдейном. Вывод уравнения скорости ферментативной реакции, описываемой схемой Михаэлиса-Ментен.
Обозначения констант скоростей:
k1 — константа скорости реакции образования фермент-субстратного комплекса из фермента и субстрата
k-1 — константа скорости реакции диссоциации фермент-субстратного комплекса на фермент и субстрат
k2 — константа скорости реакции превращения фермент-субстратного комплекса в фермент и продукт
Для фермент-субстратного комплекса применим метод квазистационарности, так как в подавляющем большинстве реакций константа скорости превращения фермент-субстратного комплекса в фермент и продукт много больше, чем константа скорости образования ферменто-субстратного комплекса из фермента и субстрата. Иными словами:
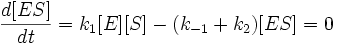
Учтем тот факт, что фермент, изначально находившийся только в свободной форме, в процессе реакции находится как в виде фермент-субстратного комплекса, так и в виде молекул свободного фермента. Таким образом:
[ E ]0 = [ E ] + [ ES ]
Преобразуем это к виду:
[ E ] = [ E ]0 − [ ES ]
И подставим в первое уравнение. После раскрытия скобок и группировки слагаемых получим следующее:
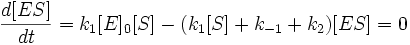
Выразим отсюда концентрацию фермент-субстратного комплекса:
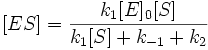
Скорость ферментативной реакции в целом (то есть скорость образования продукта) представляет собой скорость распада фермент-субстратного комплекса по реакции первого порядка с константой k2:
v = k 2[ ES ]
Подставим в эту формулу выражение, которое мы получили для концентрации ES. Получим:
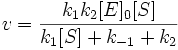
Разделим числитель и знаменатель на k1. В результате:
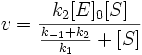
Выражение в знаменателе — (k-1+k2)/k1 — называется константой Михаэлиса (Km). Это кинетическая константа (с размерностью концентрации), которая равняется такой концентрации субстрата, при которой скорость ферментативной реакции составляет половину от максимального значения.
Для начальной стадии реакции можно пренебречь уменьшением концентрации субстрата. Тогда выражение для начальной скорости реакции будет выглядеть так:
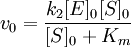
Если k-1>k2, то на первой стадии ферментативной реакции с течением времени устанавливается равновесие (квазиравновесный режим протекания реакции), и в выражение для скорости ферментативной реакции входит уже не константа Михаэлиса, а субстратная константа KS, характеризующая взаимодействие фермента с субстратом в равновесных условиях:
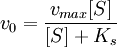 ;
; 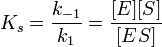
По значению KS можно судить о химическом сродстве субстрата к ферменту.
__
Ферментативный ингибитор — вещество, замедляющее протекание ферментативнойреакции. Различают обратимые и необратимые ингибиторы. Обратимые делятся наконкурентные, неконкурентные, бесконкурентные.
Изучение ингибирования ферментов играет важную роль в создании лекарств, в изучении механизма действия и структуры ферментов.
Обратимое ингибирование
 2015-08-13
2015-08-13 653
653







