Якщо два полівалентних атоми (однакові або різні валентність ≥ 2) сполучені між собою σ-зв'язком і система не є лінійна, то в такій молекулі можливе вільне обертання однієї її частини відносно іншої. В результаті такого обертання можна отримати безліч конформаційних станів, які будуть відрізнятися величиною кута повертання φ відносно якогось вибраного нульового значення. Такий кут називають діедральним або торсійним. Див.мал.
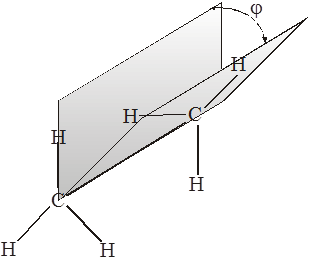
В залежності від величини цього кута по різному діють сили відштовхування і притягання між сусідніми атомами або групами і тому для таких станів буде властива різна енергія. Однак, немає потреби розглядати всі конформаційні стани. Для аналізу нам достатньо розглянути конформаційні стани з максимумом і мінімумом енергії, які ми називаємо основними конформаційними станами, або ― конфомерами. Для прикладу візьмемо найпростішу органічну речовину для якої можлива поворотна ізомерія етан. Обидва атоми карбону перебувають у sp3 гібридизованому стані і утворюють σ-зв’язки скеровані до вершин тетраедра. Розглянемо на моделі Стюарта- Брігльба такий стан, коли атоми гідрогену однієї метильної групи знаходяться навпроти атомів іншої метильної групи. Така конформація називається затіненою, або заслоненою, бо якщо ми будемо дивитися на молекулу так щоб один атом карбону закривав другий, то відповідно атоми гідрогену першого атома закривають або затіняють атоми гідрогену розташовані біля другого атома карбону. Це найменш вигідний стан, його енергія найбільша. Це і буде початковий стан, де найменші відстані між атомами гідрогену сусідніх груп, а отже найбільше діють сили відштовхування.
На листку такий стан можна зобразити двома способами:
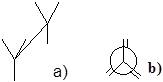 |
а)зображення молекул по типу „козла ”;
б)зображення проекційних формул Ньюмена.
Мал.1 Способи зображення затіненої конформації: а) „ козел ”, б)формула Ньюмена.
Найбільш часто будемо використовувати другий спосіб. Для цього перший атом зображаємо крапкою з якої виходить три зв’язку під кутом 120˚ а другий колом з такими ж зв’язками від круга. Повертаючи одну частину молекули відносно іншої ми досягнемо стану, коли атом гідрогену першого карбону знаходиться точно у проміжках між атомами гідрогену другого атома карбону.
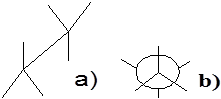 |
У другому випадку відстань між атомами гідрогену сусідніх груп найбільша, а отже, сили відштовхування найменші. Відтак енергія такого стану буде мінімальною і молекула буде прагнути якомога довше залишатися у такому стані. Звідси і його назва―загальмована конформація. На малюнку 2 наведено способи зображення загальмованих конформацій.
Мал.2. Спосіб зображення загальмованої конформації: а)„козел”; б)формула Ньютона.
Зрозуміло, що у речовині (навіть і дуже малій її кількості) є багато молекул. Тому, найчастіше говорять не про одну молекулу, а про їх сукупність. І тоді якась значна частина молекул знаходиться у найбільш вигідному енергетичному стані і менша кількість у інших, в тому числі, і у затінених станах.
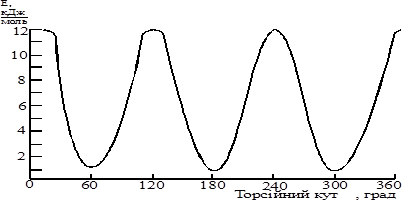 |
Отже для етану буде існувати всього два конфомери – затінений (з максимумом енергії) і загальмований (з мінімумом енергії). Величина енергетичного бар’єру є незначна і рівна 12÷12,6 кДж/моль (згідно даних із різних джерел). Тобто кожна невалентна взаємодія наближених атомів гідрогену в затіненому стані дає ≈ 4÷4,2 кДж/моль.
Діаграма
Такі стани будуть властиві і для молекули пропану. Однак, енергетичний бар’єр у даному випадку зростає до ≈ 14 кДж/моль. Таким чином просторова взаємодія гідрогену і метильної групи дає вклад ≈ 6 кДж/моль.
Якщо іти далі і розглянути конформації бутану, то тут картина буде значно складніша.
СН3-СН2-СН2-СН3.(Для зручності запису вуглеводневх радикалів у стереохімії використовують загальноприйняті скорочення: CH3-Me, C2H5-Et, C3H7-Pr, C4H9-But, C6H5-Ph.) Конформаційний аналіз слід робити по зв’язку С2-С3.
У другого і третього атомів карбону є по два атоми гідрогену і по одній метильній групі. Запишемо перший стан, коли дві метильні групи затіняють одна одну.
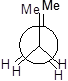
Далі для запиcу основних конформаційних станів (конфомерів) треба повертати другий атом послідовно на 60°, 120°, 180°, 240°, 300°. Отримаємо 6 конфомерів.
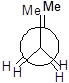
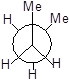
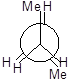

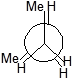
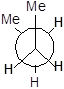
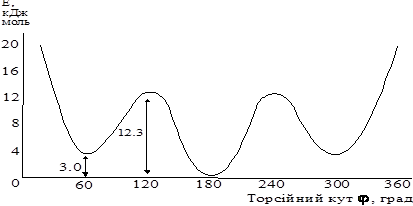 |
I II III IV V VI
Три з них є затінені і три загальмованих. Отже тут необхідно вживати більш детальну номенклатуру.
Енергетична діаграма і пояснення для бутану
ΔЕ=(20÷25 кДж/моль)
φ1і φ5 однакові ΔЕ3-1,5≈3,5кДж/моль
φ2 і φ4 однакові ΔЕ3-2,4≈12 –13 кДж\моль
 2015-08-21
2015-08-21 1152
1152







