На аноде легче окисляются электрохимически активные частицы с меньшим значением потенциала.
Анодные процессы зависят от материала анода, состава и вида электролита.
Аноды бывают растворимыми и нерастворимыми.
1. Растворимые аноды - это аноды из металлов, стоящих в ряду напряжения после алюминия (jо(Ме) > jо(Al)). Независимо от вида электролита (раствор или расплав), от вида аниона в электролите, растворимые аноды окисляются при электролизе:
А: (Ме): Ме - Zе ® Меz+ (52)
2. Нерастворимые (инертные) аноды (Pt, Au, C - графит) сами не окисляются при электролизе, а являются лишь приемником электронов от анионов. При этом анодный процесс зависит лишь от вида электролита:
а) Расплав электролита.
На нерастворимом аноде окисляются анионы независимо от их состава: SO2
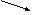
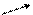 А(С): SO42-- 2e ® SO40, (53)
А(С): SO42-- 2e ® SO40, (53)
или O2
А(С): 2Сl-- 2e ® Cl2. (54)
б) Раствор электролита.
При электролизе растворов, содержащих безкислородные анионы (Cl-, Br-, I-, CN-, кроме F-), на аноде окисляются эти анионы:
АС): 2Br-- 2e ® Br20 (55)
При электролизе растворов с кислоросодержащими анионами (SO42-;NO31-;NO2-; и т.д.) на аноде в зависимости от рН раствора окисляется вода или анионы ОН-:
Анодный процесс:
а) рН £7 А(С): Н2 О -4е ® О2 + 4Н+ (56)
б) рН > 7 А(С): 4ОН--4е ® О2 + 2Н2О (57)
При этом раствор у анода подкисляется, т.е. рН уменьшается.
4.3.ЗАКОНЫ ФАРАДЕЯ
Процессы превращения веществ на электродах подчиняются законам Фарадея:
1) Массы или объемы веществ, испытавшие электрохимические превращения на электродах, прямо пропорциональны количеству прошедшего электричества.
M(B) = 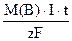 (58),
(58),
Для газообразных веществ:
V0(A) = 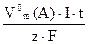 (59),
(59),
Где m(B) – масса вещества, претерпевшего электрохимическое превращение на электроде, г.
V0(A) – объем газообразного вещества при н.у., претерпевшего электрохимическое превращение на электроде, л.
М(В) – молярная масса вещества, г/моль,
V0м –молярный объем газообразного вещества при н.у., равный 22,4л
Z – число электронов в электродном процессе, определяемое из соответствующего электродного процесса.
I×t =Q – количество электричества, пропущенное через электролизер, А×с.
I – сила тока, А.
t – время электролиза, с.
2) Массы или объемы прореагировавших на электродах веществ при постоянном количестве электричества относятся между собой, как молярные массы эквивалентов или молярные объемы эквивалентов этих веществ.
Учитывая, что 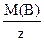 = Мэк(В),
= Мэк(В), 
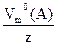 = V0эк(A), и преобразуя уравнения (58), (59), получаем при Q = const
= V0эк(A), и преобразуя уравнения (58), (59), получаем при Q = const
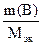 =
= 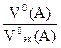 =
= 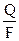
Пример11. При электролизе раствора CuSO4 на графитовых электродах масса катода увеличилась на 10,58г. Определите объем газа, выделившегося на аноде (н.у.).
Решение. Для того, чтобы определить, какие вещества выделились на электродах, напишем уравнения диссоциации CuSO4 и электродных процессов:
CuSO4 D Cu2+ + SO42-, pH < 7 из–за гидролиза
К(С): Сu2+ +2e® Cu0 z(Cu) = 2
A(C): 2H2O – 4e ® O2 + 4H+ z(O2) =4
Следовательно, на катоде выделяется медь, на аноде – газ кислород.
Мэк(Cu) = 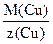 =
= 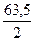
 = 31,75г/моль
= 31,75г/моль
V0эк(О2) = 
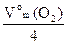 =
= 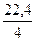 = 5,6л/моль
= 5,6л/моль
Поскольку при электролизе через катод и анод проходит одно и тоже количество электричества: Q = Qa = Qk, то
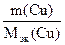 =
= 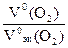
V0(О2) = 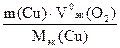 =
= 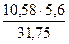 =
=  1,866л
1,866л
4.4. ВЫХОД ПО ТОКУ
При электролизе, вследствие побочных процессов, количество выделившегося вещества меньше, чем следует из закона Фарадея. К числу таких побочных процессов относятся: электродные реакции на катоде (выделение водорода) при электролизе водных растворов катионов металлов от марганца до свинца, нагревание электролита за счет его сопротивления и др. Для количественной оценки всех видов потерь используют выход по току (ВТ)
Если при электролизе протекают побочные реакции, например, при электролизе раствора ZnCl2 наряду с цинком выделяется водород.
На катоде Zn+2 +2e Zn ВТ1
2H+ +2e H2 ВТ2
ВТ =ВТ1 + ВТ2
Выходом по току (BТ) называется отношение в процентах количества электричества, израсходованного при электролизе при выделении данного вещества к общему количеству электричества, прошедшего через раствор
BТ = Qi/Q 100% (60)
или отношение массы фактически полученного продукта электролиза (mопыт) к массе теоретически (mтеор.), рассчитанной по количеству прошедшего электричества в соответствие с законом Фарадея.
BТ =(mопыт/ mтеор)×100% (61)
Пример12. Какие процессы протекают на электродах при электролизе раствора нитрата серебра с угольными электродами? Каково изменение массы катода и объем газа, выделившегося на аноде, если электролиз длится в течение 30 мин. при силе тока 3А, а ВТк =ВТа = 90%
Решение: Угольные электроды участия в электродных процессах не принимают. На катоде восстанавливаются катионы серебра, на аноде окисляются молекулы воды (NO3-, как кислородсодержащий анион, окисляется труднее воды).
К: (С): Ag+, H2O: Ag+ + e® Ag
A: (C): 2H2O – 4e® O2 + 4H+
Находим теоретическую массу серебра, которая должна выделится на катоде, используя формулу (58)
mопыт.. = m(Ag) = 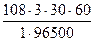 = 6,04г
= 6,04г
С учетом ВТк масса, выделившегося серебра составит
Mэксп. = 6,04×0,9 = 5,44г
Расчет теоретического объема кислорода, выделяющегося на аноде проводим по формуле (59), учитывая, что молярный объем эквивалента кислорода равен 5,6л.
V(O2)теор. = 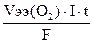 =
= 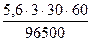 = 0,31л.
= 0,31л.
Принимая во внимание ВТа
V(O2)опыт = 0,31×0,9 =0,28л
4.5. ЗАДАЧИ.
91. Определите на сколько граммов увеличится масса катода при электролизе в течение 1 часа раствора Ca(NO3)2 при силе тока 3 А. Напишите уравнения электродных процессов, если электроды выполнены из платины.
92. При электролизе раствора ZnCl2 с графитовыми электродами в течение 1,5 часов при выходе по току ВТк = 60% масса катода увеличилась на 1,46 г. Определите силу тока, пропускаемого через электролизер и объем газа, выделившегося на аноде, если ВТа =ВТк. Напишите уравнения электродных реакций.
93. При электролизае раствора К2SO4 с графитовыми электродами при ВТА = ВТк =100% объем газа, выделившегося на катоде, составил 0,84л. Определите объем газа, выделившегося на аноде и напишите уравнения электродных реакций.
94. При пропускании через воду тока силой I = 20A на графитовом аноде выделилось 19.6л газа электричества Запишите уравнения электродных реакций, рассчитайте время электролиза и объем газа, выделившегося на аноде.
95. Рассчитайте объем газа, выделившегося на графитовом катоде (ВТк = 80%) при электролизе раствора KNO3, если при пропускании тока 10А на графитовом аноде выделился 371л газообразного вещества (ВТа =90%). Напишите уравнения электродных реакций.
96. При электролизе раствора ZnCl2 через электролизер было пропущено количество электричества Q= 48250Кл. При этом масса графитового катода увеличилась на 9,8г, а на графитовом аноде выделилось 2 л газообразного вещества. Напишите уравнения электродных реакций и рассчитайте ВТа и ВТк..
97. Определите на сколько граммов изменится масса анода при пропускании тока в 3А в течение 1 часа через раствор FeCl2, если электроды выполнены из б) железа, а ВТа = 82 % Напишите уравнения электродных реакций.
98.При электролизе раствора FeCl2 c платиновыми электродами на аноде выделилось 10 л газа при ВТа = 75%. Рассчитайте, на сколько граммов увеличится масса катода, если ВТк =80%.Напишите уравнения электродных реакций.
99. Рассчитайте, какой ток нужно пропустить через раствор СrCl3 в течение 2,5 часов, чтобы масса графитового (С) катода увеличилась на 2,26г (ВТк = 70%). Рассчитайте объем газа, выделившегося на С-аноде. Напишите уравнения электродных реакций.
100. При электролизе раствора CuSO4 с графитовыми электродами масса катода увеличилась на 1000г (ВТк = 95%).Напишите уравнения электродных реакций и рассчитайте объем газа, выделившегося на аноде., если ВТа = 98%.
101.При пропускании через раствор MgSO4 количества электричества Q = 2423К на аноде выделилось 103 л газа. Напишите уравнения электродных реакций и рассчитайте выход по току на аноде, если электроды выполнены из графита.
102. За 10 часов электролиза раствора MgCl2 с графитовыми электродами масса катода увеличилась на 500 г. ВТк = 85%. Рассчитайте силу тока, пропускаемого через электролизер. Напишите уравнения электродных реакций.
103.Через раствор Ni(NO3)2 пропускался ток силой I = 3,5А в течение 2 часов. При условии, что ВТа = 80%, рассчитайте: а)изменение массы анода, если электроды выполнены из никеля, б) объем, выделившегося на аноде газа, если электроды выполнены из платины.
104. При электролизе раствора CoSO4 масса катода увеличилась на 103 г. при ВТк = 80% рассчитайте: а) количество электричества Q, прошедшего через электролизер, б) объем газа, выделившегося на графитовом аноде, в) изменение массы анода, если он выполнен из кобальта.
105. При пропускании тока I = 3,0А через раствор CuCl2 масса катода увеличилась на 6 г (ВТк = 90%). Рассчитайте а) время электролиза и объем газа, выделившегося на аноде (ВТа = 90%), если электроды выполнены из графита, б) изменение массы анода, если он выполнен из меди.
106. При пропускании тока I=10А через электролизер с раствором Cr2(SO4)3 масса катода увеличилась на 3 г. ВТк = 60%. Рассчитайте: а) время осуществления электролиза и объем газа, выделившегося на аноде, если электроды выполнены из: графита.
107. Через раствор NiSO4 в течение времени t = 2 час. пропускался ток I=1А ВТк = 80% и ВТа = 80%. Рассчитайте изменение массы катода и объем газа, выделившегося на аноде, если электроды выполнены из графита. Напишите реакции, протекающие на электродах
108. При пропускании электрического тока через раствор CaCl2 в течение 1 часа на аноде выделилось 4 л газообразного вещества. Рассчитайте силу току, пропущенного через электролизер, если электроды выполнены из графита. Запишите уравнения электродных реакций.
109. При пропускании тока силой I = 4А через раствор PbCl2 масса катода увеличилась на 16 г. Рассчитайте время пропускания тока, t и объем газа, выделившегося на аноде, если электроды выполнены из графита.
110. Через раствор HgCl2, пропущен ток I = 4 А в течение 1 часа. При этом масса катода увеличилась на 14,2 г. Рассчитайте ВТк и объем газа, выделившегося на аноде (Va), если электроды выполнены из: а) графита, б) золота.
111. Через расплав NaJ пропущен ток силой I = 100A в течение 1 часа. Рассчитайте, как изменится масса катода, если электроды графитовые. ВТк = 100%.
112. Через раствор AgNO3 пропускали ток силой I = 4A в течение 4 часов. Найдите изменение массы катода и объем газа, выделившегося на аноде, если ВТа=ВТк = 90%, а электроды выполнены из графита. Напишите уравнения электродных процессов, протекающих на электродах, выполненных из серебра.
113. При пропускании тока I = 3А в течение 1 часа через расплав КОН масса катода изменилась на 4,5 г. Рассчитайте ВТк и объем газа, выделившегося на аноде, если электроды графитовые. (ВТк = ВТа).
114. При электролизе через расплав NaCl было пропущено 8,64×104Кл электричества. При этом на аноде выделилось 105л хлора. Рассчитайте на сколько изменилась масса катода, если электроды выполнены из графита (ВТа = ВТк). Запишите уравнения электродных процессов, протекающих на графитовых электродах.
115.При электролизе раствора CdSO4 в течение 2,5 часов масса катода изменилась на 21,25г. Рассчитайте силу тока, пропущенного через электролизер и объем газа, выделившегося на аноде, если электроды выполнены из: а) графита. ВТа = 75%, ВТк = 80%. Напишите уравнения электродных реакций.
116. При электролизе через раствор SnCl2 было пропущено 24125Кл электричества. Рассчитайте изменение массы анода, если электроды выполнены из олова. Выход по току на оловянном электроде составляет 85%. Рассчитайте объем водорода, выделяющегося одновременно с осаждением Sn.

Таблица 1
 2015-08-21
2015-08-21 7238
7238








