Термодинамика равновесных электродных процессов
Гальванический элемент ‑ устройство, обеспечивающее перевод энергии окислительно-восстановительной химической реакции в электрическую путем разделения процессов окисления и восстановления в пространстве.
Электрод ‑ устройство, обеспечивающее протекание процесса окисления или восстановления.
Любой гальванический элемент состоит как минимум из двух электродов.
Пример 1. Известно, что цинк восстанавливает медь из солей в растворах.
Cu2++Zn= Zn2++Cu
Zn-2e®Zn2+
Cu2++2e®Cu
Опустим цинковую пластину в раствор ZnSO4, а медную пластину в раствор CuSO4.
Соединим пластины металлической проволочкой, обеспечивающей перенос заряда электронами, а два раствора соединим проводящим водным раствором, обеспечивающим перенос заряда ионами.
В таком случае процесс перехода одного атома цинка в раствор сопровождается, с одной стороны, увеличением числа электронов на пластине, а с другой ‑ увеличением числа положительно заряженных ионов (катионов) в растворе. При этом ионы меди, получая электроны, восстанавливаются и осаждаются на металлическую пластину. На цинковой пластине имеется избыток электронов, а на медной ‑ недостаток, что компенсируется переходом электронов по проволоке.
Фактически создано устройство, в котором реализуется направленное движение заряженных частиц, то есть электрический ток.
Гальванические элементы принято описывать в виде схемы, показывающей, какие фазы находятся в контакте. Согласно принятым правилам слева указывается электрод, на котором происходит процесс окисления, а справа ‑ восстановления. Граница раздела фаз обозначается вертикальной чертой, а если в контакте с какой либо фазой находится несколько фаз, то они указываются подряд, через запятую. Так медно-цинковый гальванический элемент может быть схематично описан следующим образом:
Zn½ZnSO4½CuSO4½Cu.
Чтобы избежать смешивания водных растворов электролитов, их соединяют не напрямую, а через солевой мостик, т.е. насыщенный раствор какой-нибудь соли.
Zn½ZnSO4½KNO3(нас)½CuSO4½Cu.
Он не оказывает влияния на термодинамические характеристики элемента, но вносит стабильность в его работу. Поэтому в схеме часто его не пишут.
Zn½ZnSO4½½CuSO4½Cu
Термодинамическое описание процессов, протекающих в гальваническом элементе. Так как для процессов, протекающих при постоянных p и T, энергия Гиббса связана с работой обратимого процесса, то есть с максимальной работой, которую может совершить система 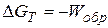 .
.
E ‑ электродвижущая сила (ЭДС), работа обратимого процесса по переносу единичного положительно заряда с одного электрода гальванического элемента на другой при постоянных температуре и давлении, т.е. 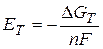 , n ‑ число элементарных зарядов, участвующих в элементарном процессе
, n ‑ число элементарных зарядов, участвующих в элементарном процессе 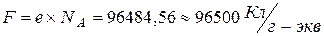 ‑ постоянная Фарадея ‑ максимальное количество электричества, которое может быть перенесено одним молем однозарядных ионов.
‑ постоянная Фарадея ‑ максимальное количество электричества, которое может быть перенесено одним молем однозарядных ионов.
ЭДС гальванического элемента величина положительная, т.к. DG самопроизвольного процесса меньше нуля.
 2015-08-21
2015-08-21 901
901








