В настоящее время применяются два способа трансплантации сердца – ортотопический и гетеротопический. Ортотопическая трансплантация представляет собой замену сердца реципиента здоровым аллотрансплантатом донора и является методом выбора. Гетеротопичекая трансплантация – дополнительная подсадка аллотрансплантата к сердцу реципиента. Она выполняется редко и в тех случаях, когда ортотопическая трансплантация невозможна из-за малых размеров сердца донора для организма реципиента или при высоком легочном сосудистом сопротивлении реципиента.
Хирургическая техника ортотопической трансплантации сердца практически не изменилась в сравнении с оригинальным описанием N. Shumway. После срединной стернотомии и продольного рассечения перикарда проводится полная гепаринизация больного. Канюляция полых вен и аорты проводится максимально дистально. Полые вены обходятся турникетами. Искусственное кровообращение проводится в режиме умеренной гипотермии (30°C). Полые вены обжимаются турникетами, накладывается поперечный зажим на восходящую аорту. Магистральные сосуды пересекаются выше комиссур полулунных клапанов. Предсердия отсекаются по линии атриовентрикулярной борозды с оставлением манжеты для фиксации аллотрансплантата. Удаление ушек предсердий уменьшает риск образования тромбов. После кардиоэктомии ближайшие 1-2 см аорты и легочной артерии отделяются друг друга электроножом таким образом, чтобы не повредить правую ветвь легочной артерии. Легочный венозный возврат забирается дренажем через правую верхнюю легочную вену.
Согласование по времени эксплантации сердца у донора и кардиоэктомии у реципиента является основой минимизации срока ишемии аллотрансплантата и длительности ИК реципиента. Частая коммуникация между группами забора и пересадки обеспечивает оптимальную координацию процедур. Идеально, если кардиоэктомия у реципиента закончена непосредственно перед прибытием сердечного аллотрансплантата.
Имплантация аллотрансплантата сердце донора извлекается из транспортного контейнера и помещается в холодный физиологический раствор. Электроножом разделяются аорта и легочная артерия. Левое предсердие оценивается на соответствие размеру оставшейся части предсердия реципиента с устьями легочных вен. Лишняя ткань отсекается и формируется круглая манжета, скроенная по размеру остатка предсердия реципиента. Имплантация начинается сшиванием предсердий от уровня левой верхней легочной вены (рис. 2).
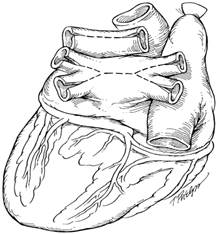
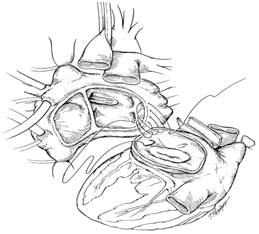
Рис. 2. Подготовка аллотрансплантата и анастомоз левого предсердия
Важно непрерывно оценить соответствие размера между предсердиями реципиента и донора для своевременной пликации лишней ткани. После завершения анастомоза левого предсердия проводится криволинейный разрез от отверстия нижней полой вены к ушку правого предсердия аллотрансплантата. Эта модификация правой атриотомии, первоначально предложенная C. Barnard, уменьшает риск повреждения синусового узла. Выполняется анастомоз правого
предсердия (рис. 3).
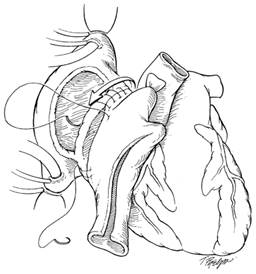
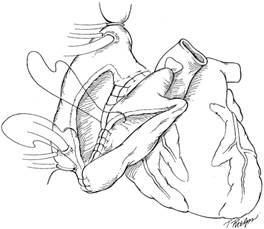
Рис. 3. Завершение анастомоза левого и анастомоз правого предсердия
Легочная артерия аллотрансплантата резецируется, чтобы устранить возможный кинкинг. Выполняется анастомоз легочной артерии. Аортальный анастомоз выполняется последним (рис. 4). После деаэрации снимается аортальный поперечный зажим. Половине пациентов требуется дефибрилляция. Линии шва тщательно проверяются на гемостаз. Проводится инфузия инотропных препаратов для достижения ЧСС 90-110 уд. в мин. Прекращается ИК, к правому предсердию и желудочку аллотрансплантата подшиваются временные эпикардиальные электроды. Дренирование перикарда, средостения и закрытие раны проводится стандартным способом.
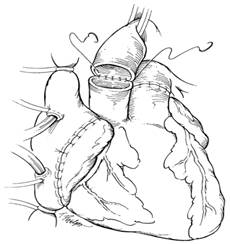
Рис. 4. Заключительный этап имплантации аллотрансплантата
Послеоперационный период Физиология аллотрансплантата. Лишенный центрального влияния синусовый узел пересаженного сердца обеспечивает увеличенную по сравнению с нормой ЧСС в покое до 90-110 уд. в мин. Изменение частоты сердечных сокращений и сердечного выброса в ответ на стресс (гиповолемия, гипоксия, анемия) происходит за счет гуморального фактора с небольшой задержкой, пока циркулирующие катехоламины не проявят положительный хронотропный эффект на пересаженное сердце. Денервация изменяет ответ сердца на внешние воздействия, действующие непосредственно через автономную нервную систему сердца. Вследствие истощения миокардиальных резервов катехоламинов, связанных с длительной инотропной поддержкой донора, аллотрансплантат часто требует высоких доз катехоламинов. Коррекция гемодинамики. В раннем послеоперационном периоде наблюдается депрессия миокарда аллотрансплантата, обусловленная гипотонией у донора, гипотермией и длительной ишемией. Инфузия адреналина или добутамина в сочетании с коротропом или левосименданом, рутинно начинающаяся в операционной, обычно обеспечивает достаточную временную поддержку, которая постепенно прекращается в течение 2-4 дней после восстановления нормальной функции миокарда аллотрансплантата. Острая сердечная недостаточность, являющаяся следствием легочной гипертензии, ишемического повреждения во время консервации и острого отторжения, служит причиной 25% летальных исходов в госпитальном периоде. При отсутствии эффекта от медикаментозного лечения необходимо применение интрааортальной баллонной контрпульсации или обхода ЛЖ. Ретрансплантация в таких ситуациях связана с очень высокой смертностью.
Иммуносупрессивная терапия Способность организма отличать собственные белки от чужеродных является основой его выживания во враждебной окружающей среде. При трансплантации защитные механизмы реципиента опознают человеческий лейкоцитарный антиген (HLA) на клетках аллотрансплантата и стремятся уничтожить чужеродные клетки. Цель иммуносупрессивной терапии – селективная модуляция иммунного ответа реципиента для предотвращения реакции отторжения и одновременно сохранение иммунной защитной функции против инфекции или неоплазии при минимизации токсичности иммуносупрессивных препаратов. Иммуносупрессия после трансплантации состоит из двух фаз: ранней индукции и долговременной поддержки. Эта стратегия по существу универсальна, хотя выбор иммуносупрессивных препаратов, их комбинаций и дозировок отличается в различных центрах трансплантации. Так как реакция отторжения аллотрансплантата является самой интенсивной в раннем послеоперационном периоде, иммуносупрессивная терапия также должна быть наиболее интенсивной в фазу индукции. В РНПЦ «Кардиология» используется тройной иммуносупрессивный режим, включающий терапию тремя препаратами: такролимус (програф), стероиды и микофенолат мофетил (селлсепт). Антитимоцитарный глобулин (ATG) используется как часть протокола фазы индукции. Применение его в раннем послеоперационном периоде позволяет уменьшить гормональную терапию и отсрочить использование такролимуса при риске развития почечной недостаточности. Использование множественного лекарственного режима позволяет проводить адекватную иммуносупрессию с уменьшенными дозами отдельных препаратов для минимизации их токсичности.
Острое отторжение аллотрансплантата Реакция отторжения сердечного аллотрансплантата – нормальный ответ хозяина на чужеродные клетки. Она обусловлена в большинстве случаев проявлением клеточного иммунитета через каскад событий, вовлекающих макрофаги, цитокины и T-лимфоциты. Гуморальная реакция отторжения менее обычна. 80% эпизодов острых реакций отторжения наблюдаются в первые 3 месяца после трансплантации, и большинство реципиентов имеет по крайней мере один такой эпизод. Основными факторами риска являются женский пол, наличие высокого титра HLA, а также использование аллотрансплантатов от молодых доноров и женщин. Несмотря на то что 80-96% острых реакций могут быть подавлены только одной терапией кортикостероидами, отторжение – все еще основное осложнение после трансплантации сердца. Эндомиокрадиальная биопсия правого желудочка остается «золотым» стандартом для постановки диагноза острого отторжения. Для получения биоптата используется чрезкожный доступ через бедренную вену. Биоптаты из межжелудочковой перегородки фиксируется в формалине, после чего проводится его гистологическое исследование. Биопсия первоначально выполняются каждые 7-10 дней с постепенным урежением до одного раза в течение 3-6 месяцев после первого года. Глубина и плотность лимфоцитарной инфильтации, а также наличие некроза кардиомиоцитов в биоптате определяют степень клеточной реакции отторжения.
Инфекционные осложнения Инфекция – одна из основных причин смертности после пересадки сердца. Подавление защитных механизмов реципиента вследствие хронической иммуносупрессии является первичным фактором предрасположенности к увеличенной восприимчивости к болезнетворным микроорганизмам. Наиболее опасные периоды развития инфекционных осложнений соответствуют первым 3 месяцам после трансплантации, а также острым кризам отторжения и связанной с ними увеличенной иммуносупрессии.
При выявлении доноров с серопозитивными реакциями на cytomegalovirus или Toxoplasma gondii проводится профилактика реципиента, если он серонегативен. Введением цефалоспорина первого поколения, или ванкомицина (для пациентов с β-лактамной аллергией) должно быть начато до индукции в наркоз и продолжено в течение нескольких суток после трансплантации. Реципиенты поступают и находятся в послеоперационном периоде в специальной палате интенсивной терапии. Тщательно соблюдаются обычные санитарно-гигиенический мероприятия без дополнительного обсервационного режима.
Хронические осложнения после трансплантации сердца
Долгосрочная выживаемость реципиентов прежде всего ограничена развитием патологии коронарных артерий аллотрансплантата, являющейся ведущей причиной смерти позже первого года после трансплантации. Этиология васкулопатии аллотрансплантата многофакторная и включает как иммунологические, так и неиммунологические компоненты. В настоящее время доказано, что иммунологический компонент имеет более важное значение, хотя такие факторы, как возраст донора, гиперхолестеринемия и инфицирование цитомегаловирусом, также являются факторами риска развития этого осложнения. П ричиной хронической почечной дисфункции у больных после трансплантации сердца является необратимый промежуточный фиброз, вызванный нефротоксическим эффектом такролимуса. Патогенез развития почечной недостаточности является следствием афферентной констрикции сосудов с вторичной ишемией. Наиболее выраженное поражение почек развивается в течение первых 6 месяцев после трансплантации и прямо пропорционально зависит от уровня такролимуса крови. Основными профилактическими мерами являются частый контроль уровня такролимуса и поддержание достаточного внутрисосудистого объема. У 3-10% пациентов развивается терминальная почечная недостаточность, требующая диализа или почечной трансплантации. Системная гипертония наблюдается у 50-90% больных после трансплантации сердца. Основную роль в развитии осложнения играет спазм периферических сосудов в комбинации с задержкой жидкости в результате воздействия такролимуса на трубчатый почечный эпителий и системные артериолы, иннервируемые симпатической нервной системой. Не существует какого-либо единственного класса противогипертонических средств для эффективной коррекции гипертонии у реципиентов, и лечение резистеной гипертонии остается эмпирическим и сложным.
Хроническая иммуносупрессия связана с увеличенным риском развития новообразований. Предполагаемый риск карциномы у реципиентов сердца почти в 100 раз выше, чем в общей популяции. Ослабление контроля T-лимфоцитов над Epstein-Barr virus стимулирует быстрое увеличение B-лимфоцитов, которое приводит к развитию лимфом. Процесс может усилиться после применения моно- или поликлональной терапии антителами. Варианты лечения в дополнение к обычной терапии (химиотерапия, лучевая терапия и хирургическая резекция) включают сокращение иммуносупрессии и снижение дозы ацикловира. Несмотря на эти усилия, смертность остается высокой.
Гиперхолестеринемия развивается у большинства реципиентов сердца и корригируется диетой и статинами. Другие осложнения, которые характерны в отдаленном посттрансплантационном периоде, включают остеопороз, ожирение, аваскулярный некроз у больных с избыточным весом и холелетиаз.
 2015-08-21
2015-08-21 572
572








