ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
НИЖЕГОРОДСКИЙ ГОСУДАРСТВЕННЫЙ
ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ им. Р.Е.АЛЕКСЕЕВА
Кафедра «Общая и неорганическая химия»
СПРАВОЧНЫЕ МАТЕРИАЛЫ
ПО КУРСУ ОБЩЕЙ И НЕОРГАНИЧЕСКОЙ ХИМИИ
Для студентов всех специальностей дневной и вечерней форм обучения
(Выпуск 3)
Нижний Новгород 2010
Составители: Л.Н.Четырбок, А.Д.Самсонова, В.И. Наумов, Г.Н.Борисова, А.В.Борисов
УДК 54 (07)
Справочные материалы по курсу общей химии для студентов всех
специальностей дневной и вечерней форм обучения/НГТУ; Сост.: Л.Н.Четырбок, А.Д.Самсонова и др.. Н.Новгород, 2009.- 36с.
Приведены справочные материалы для практических и лабораторных
занятий по курсу общей и неорганической химии.
Научный редактор Г.Н. Паниичева
Редактор Э..Б.Абросимова
Подп. к печ. Формат 60×841/16. Бумага газетная. Печать офсетная. Печ.л.. Уч.-изд.л.. Тираж 2000 экз. Заказ.
-----------------------------------------------------
Нижегородский государственный технический университет.
Типография НГТУ. 603600, Н.Новгород, ул. Минина, 24.
© Нижегородский государственный
технический университет, 2010
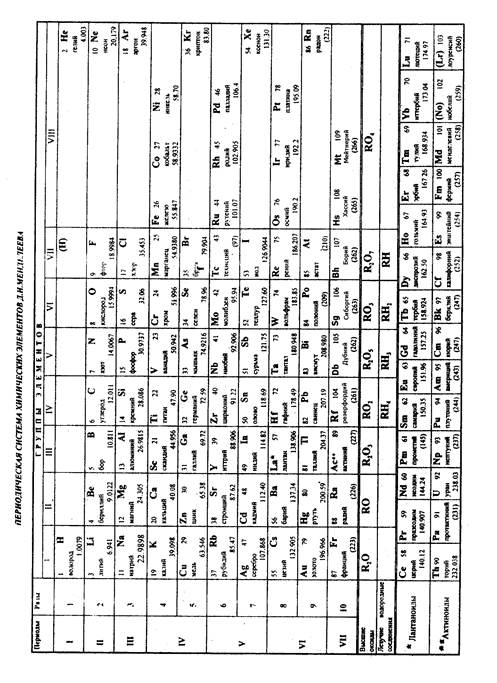
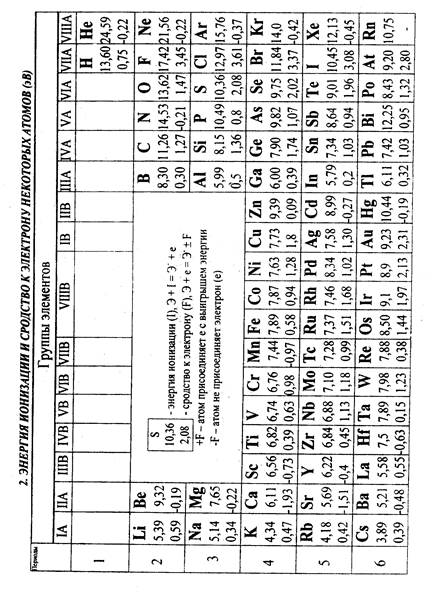
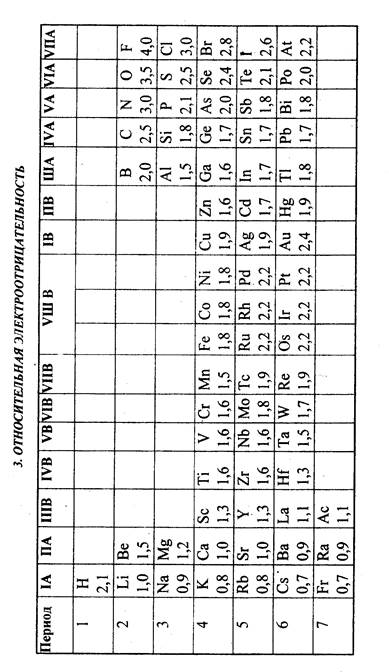
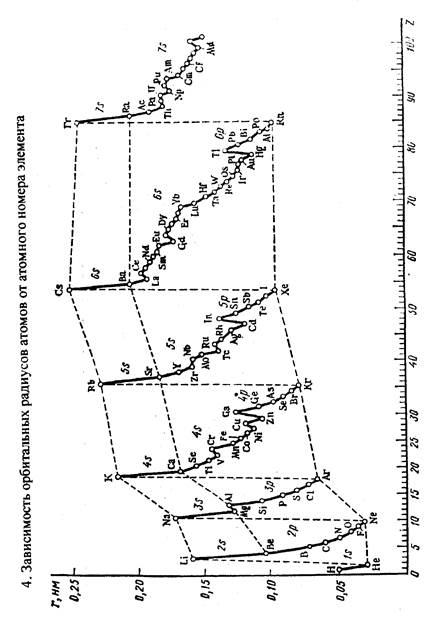
5. ПЕРИОДИЧЕСКАЯ ЗАВИСИМОСТЬ СРОДСТВА К ЭЛЕКТРОНУ (F1) И ПЕРВОЙ ЭНЕРГИИ ИОНИЗАЦИИ(I1 ) АТОМОВ ОТ АТОМНОГО НОМЕРА ЭЛЕМЕНТА
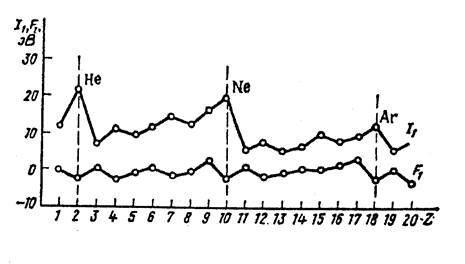 Сродство к электрону взято с обратным знаком, т.е. приведены первые энергии ионизации отрицательно заряженных ионов Э-
Сродство к электрону взято с обратным знаком, т.е. приведены первые энергии ионизации отрицательно заряженных ионов Э-
6. СВЕДЕНИЯ О НЕКОТОРЫХ ЭЛЕМЕНТАРНЫХ ЧАСТИЦАХ
| Частица
| Символ
| Масса покоя
| Заряд, Кл
| Заряд
|
| Кг
| относительная масса
|
| Протон Нейтрон Электрон
| Р
n
e
| 1,673 10-27 1,675 10-27 9,109 10-31
| 1,007276
1,008665
0,000549
| 1,602 10-19 0
1,602 10-19
| +1
-1
|
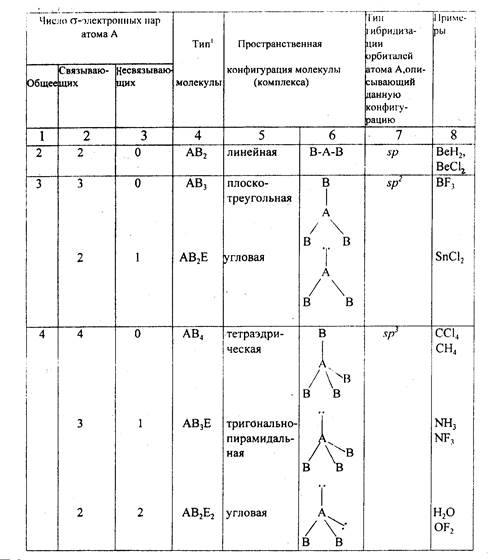
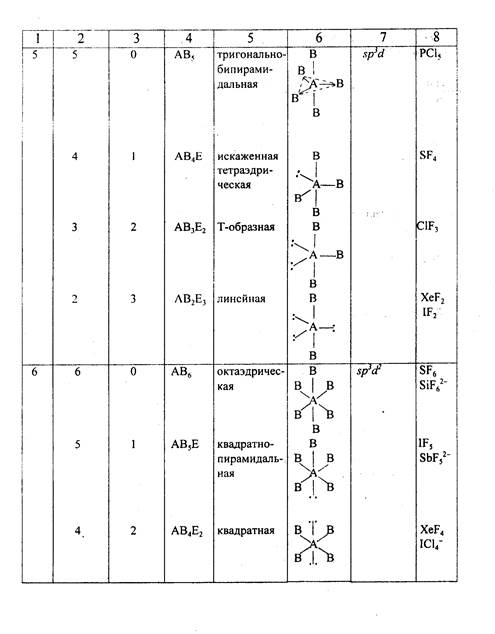
7. РАСПОЛОЖЕНИЕ ВАЛЕНТНЫХ σ-ЭЛЕКТРОННЫХ ПАР
ЦЕНТРАЛЬНОГО АТОМА "А" И ПРОСТРАНСТВЕНННАЯ
КОНФИГУРАЦИЯ МОЛЕКУЛ (КОМПЛЕКСОВ) АВn
8. СТРОЕНИЕ И ЭЛЕКТРИЧЕСКИЕ МОМЕНТЫ ДИПОЛЕЙ (μ) НЕКОТОРЫХ МОЛЕКУЛ
| Тип
| Пространственная конфигурация
| Молекула
| μ∙1029, Кл×м
|
| A2
| |
| |
| | АВ
| |
| |
| |
| |
| | AB2
| |
| |
| | AB2
| |
| |
| |
| | ABC
| |
| | AB3
| |
| | AB3
| |
| |
| |
| | AB4
| |
| | AB5
| | AB6
|
| | Гантелевидная
| |
| |
| | Гантелевидная
| |
| |
| |
| |
| | Линейная
| |
| |
| | Угловая
| |
| |
| |
| | Линейная
| |
| | Плоскотреугольная
| |
| | Тригонально-пирамидальная
| |
| |
| |
| | Тетраэдрическая
| |
| | Тригонально - бипирамидальная
| | Октаэдрическая
|
| | H2
| | Cl2
| | N2
| | CO
| | NO
| | HF
| | HCI
| | HBr
| | CO2
| | CS2
| | BeCl2
| | H2O
| | H2S
| | NO2
| | SO2
| | COS
| | HCN
| | BF3
| | SO3
| | NH3
| | PCl3
| | PH3
| | NF3
| | CH4
| | CC14
| | PC15
| | SF6
|
| |
| |
| |
| | 0,033
| | 0,023
| | 0,640
| | 0,347
| | 0,263
| |
| |
| |
| | 0,610
| | 0,340
| | 0,097
| | 0,531
| | 0,22
| | 0.97
| |
| |
| | 0,494
| | 0,370
| | 0,183
| | 0,07
| |
| |
| |
| |
|
|
9. ДЛИНА (d) И ЭНЕРГИИ (Е) ХИМИЧЕСКОЙ СВЯЗИ
| Связь
| d, нм
| Е, кДж/моль
| Связь
| d, нм
| Е, кДж/моль
|
| C-C
| | c=c
| | c=c
| | C-H
| | C-F
| | C-C1
| | C-l
| | C-Br
| | C-0
| | C=0
| | Si-Si
| | Ge-Ge
| | Sn - Sn (P)
|
| | 0,154
| | 0,135
| | 0,120
| | 0,109
| | 0,136
| | 0,176
| | 0,215
| | 0,194
| | -
| | 0,116
| | 0,234
| | 0,244
| | 0,316
|
|
| | Pb-Pb
| | Si-H
| | Si-F
| | Si-Cl
| | Si-Br
| | Si-I
| | Ge-H
| | Gc - Cl
| | Ge-Br
| | Sn -11
| | Sn-Cl
| | Sn - Br
| | Pb-H
|
| | 0,350
| | 0,148
| | 0,155
| | 0,201
| | 0,215
| | 0,243
| | 0,153
| | | | | | 0,170
| | | | | | |
|
|
10. ПАРАМЕТРЫ ХИМИЧЕСКОЙ СВЯЗИ ДВУХАТОМНЫХ МОЛЕКУЛ
| Молекула
| Энергия связи,
кДж/моль
| Длина связи,
нм
| Энергия иони-зации, эВ
| Сродство к электрону, эВ
|
| I
|
|
|
|
|
|
| II
|
| | 0,042
| | 498,6
| | 159,2
| | 243,0
| | 192,7
| | 150,8
| | 632,7
|
| | 0,292
| | 0,121
| | 0,142
| | 0,199
| | 0,228
| | 0,267
| | 0,115
|
| | 22,45
| | 12,11
| | 16,50
| | 11,51
| | 10,64
| | 9,29
| | 9,29
|
| |
| | 0,497
| | 3,08
| | 2,40
| | 2,59
| | 2.49
| |
|
|
| III
|
|
|
|
|
|
Молекулы группы I при ионизации теряют связывающие электроны, мо-лекулы группы II – теряют разрыхляющие электроны, а молекулы группы III теряют не связывающие электроны
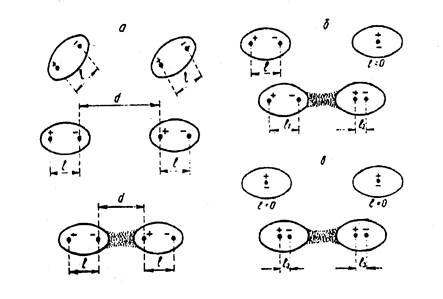 11. ТИПЫ МЕЖМОЛЕКУЛЯРНЫХ ВЗАИМОДЕЙСТВИЙ
11. ТИПЫ МЕЖМОЛЕКУЛЯРНЫХ ВЗАИМОДЕЙСТВИЙ
а -ориентационное; б – индукционное; в – дисперсионное; l – длина диполя; d – межмолекулярное расстояние
12. ВКЛАД ОТДЕЛЬНЫХ СОСТАВЛЯЮЩИХ В ПОЛНУЮ ЭНЕРГИЮ МЕЖМОЛЕКУЛЯРНОГО ВЗАИМОДЕЙСТВИЯ
| Вещество
| Электрический
момент диполя
молекулы×1029,
Кл×м
| Поляри-
зуемость
| Эффект, кДж/моль
| Суммарная
энергия,
кДж/моль
| Температу-
ра кипения,
К
|
| ориента-
ционный
| индук-
циионный
| диспер-
сионный
|
| H2
| | Ar
| | Xe
| | Co
| | HCl
| | HBr
| | Hi
| | NH3
| | H2O
|
| |
| |
| |
| | 0,39
| | 3,4
| | 2,57
| | 1,25
| | 4,95
| | 6,07
|
| | 0,20
| | 1,63
| | 4,00
| | 1,99
| | 2,63
| | 3,58
| | 5,4
| | 2,21
| | 1,48
|
| |
| |
| |
| |
| | 3,34
| | 1,09
| | 0,58
| | 13,28
| | 36,32
|
| |
| |
| |
| |
| | 1,003
| | 0,71
| | 0,295
| | 1,55
| | 1,92
|
| | 0,17
| | 8,48
| | 18,4
| | 8,79
| | 16,72
| | 28,42
| | 60,47
| | 14,72
| | 8,98
|
| | 0,17
| | 8,48
| | 18,4
| | 8,79
| | 21,05
| | 30,22
| | 61,36
| | 29,55
| | 47,22
|
|
|
13. ТЕРМОДИНАМИЧЕСКИЕ КОНСТАНТЫ НЕКОТОРЫХ ВЕЩЕСТВ
| Вещество
| DH  ,кДж/моль ,кДж/моль
| DG  ,кДж/моль ,кДж/моль
| S  ,Дж/моль.К ,Дж/моль.К
|
| Ag (к)
|
|
| 42,6
|
| Ag +(р)
| 105,6
| 77,2
| 72,7
|
| Ag Br (к)
| -100,3
| -97,3
| 107,2
|
| Ag2Cr04 (к)
| -721,3
| -635,0
| 217,6
|
| AgCl (к)
| -127,2
| -109,9
| 96,2
|
| AgI (к)
| -66,9
| -66.4
| 115,5
|
| АgNО3 (к)
| -124,6
| -33,6
| 141,0
|
| Ag20 (к)
| -31,2
| -11,3
| 122,0
|
| Ag2S (к)
| -32,8
| -40,8
| 144,0
|
| Ag2S04 (к)
| -717,7
| -620,0
| 199,9
|
| Аl (к)
|
|
| 28,4
|
| Аl3+ (р)
| -530,0
| -490,5
| -301,0
|
| АIВr3 (к)
| -513,4
| -490,6
| 180,2
|
| АI4С3 (к)
| -209
| -196
| 88,95
|
| АIСl3 (к)
| -704,6
| -629,0
| 109,4
|
| А1F3 (к)
| -1511,4
| -1432,1
| 66,5
|
| AIN (к)
| -318
| -287,4
| 20.2
|
| Аl(ОН)3 (к)
| -1315
| -1157
| 70,1
|
| Аl(ОН)4- (р)
| -1507,5
| -1307,5
| 89,7
|
| А12О3 (к)
| -1676,8
| -1583,3
| 50,95
|
| АI2S3 (к)
| -723,4
| -492,5
|
|
| АI2(SО4)З (к)
| -3444,1
| -3102,9
| 239,4
|
| As (серый)
|
|
| 35,6
|
| АsСI3 (ж)
| -305,0
| -268,4
| 212,5
|
| Аs2Оз (к)
| -619,2
| -538,0
| 101,7
|
| As205(к)
| -914,6
| -772,4
| 105,4
|
| Аu (к)
|
|
| 47,44
|
| АuСl (к)
| -36,4
| -14,6
| 85,98
|
| АuСl3 (к)
| -118,4
| -53,6
| 164,4
|
| Аu203 (к)
| -13,0
| -48,77
|
|
| B (к)
|
|
| 5,8
|
| BBr3 (ж)
| -243,0
| -237,5
| 228,5
|
| ВСl3 (ж)
| -427,2
| -387,2
|
|
| В2Н6(г)
| 38,5
| 89,6
|
|
| Вещество
| DH  ,кДж/моль ,кДж/моль
| DG  ,кДж/моль ,кДж/моль
| S  ,Дж/моль.К ,Дж/моль.К
|
| BN (к)
| -252,8
| -226,8
| 14,8
|
| В2О3 (к)
| -1273.8
| -1193.7
| 54,0
|
| НВО2 (к)
| -795
| -736,1
| 240,2
|
| Н3ВО3 (к)
| -1094,9
| -951,8
| 88,8
|
| Ва (к)
|
|
|
|
| Ва2+ (р)
| -538,0
| -561,1
| 9,6
|
| ВаСО3 (к)
| -1217,1
| -1137,2
| 113,0
|
| ВаСl2 (к)
| -859,1
| -811,4
| 123,8
|
| BaCrO4 (к)
| -1368
| -1325,2
| 155,6
|
| ВаО (к)
| -553,9
| -525,4
| 70,5
|
| Ва(ОН)2 (к)
| -945,4
| -855,4
| 100,5
|
| BaS (к)
| -460,5
| -456
| 78,3
|
| BaSO4 (к)
| -1474,2
| -1363,2
| 132,3
|
| Ве (к)
|
|
| 9,5
|
| ВеСО3 (к)
| -982
| -944,7
| 67,29
|
| ВеС12 (к)
| -494
| -468
|
|
| BeF2 (к)
| -1010
| -941
|
|
| ВеО (к)
| -598
| -582
| 14,1
|
| Ве(ОН)2 (к)
| -907
| -818
| 55,6
|
| BeS04(к)
| -1197
| -1088
|
|
| Bi (к)
|
|
| 56,9
|
| Вi(ОН)3 (к)
| -711,8
| -580,3
|
|
| Вi2О3 (к)
| -578,2
| -497,7
|
|
| Вr- (р)
| -131,2
| -107,1
| 83,3
|
| Вr2 (ж)
|
|
| 152,2
|
| НBr (г)
| -36,1
| -53,4
| 198,7
|
| С (алмаз, к)
| 1,828
| 2,834
| 2,37
|
| С (графит, к)
|
|
| 5,740
|
| СВr4 (г)
| 79,50
| 66,94
| 230,12
|
| CC14 (ж)
| -135,44
| -64,7
| 214,6
|
| CC14 (г)
| -102,93
| -60,63
| 309,74
|
| СН4 (г)
| -74,86
| -50,85
| 186,44
|
| C2H2(г)
| 226,17
| 208,61
| 200,97
|
| С2Н4 (г)
| 52,28
| 68,12
| 219,4
|
| С2Н6 (г)
| -54,67
| -32,89
| 229,5
|
| C3H8 (г)
| -103,92
| -23,49
| 270,09
|
| Вещество
| DH  ,кДж/моль ,кДж/моль
| DG  ,кДж/моль ,кДж/моль
| S  ,Дж/моль.К ,Дж/моль.К
|
| C4H6 (г)
| 110,24
| 150,77
| 278,92
|
| н-C4H10 (г)
| -126,23
| -17,17
| 310,33
|
| н-C5H12 (г)
| -146,54
| -8,37
| 349,18
|
| C6H6 (г)
| 82,98
| 129,75
| 269,38
|
| C6H12 (г)
| -123,22
| 31,78
| 298,44
|
| н-C6H14 (г)
| -167,30
| -0,25
| 388,66
|
| CН3ОH (г)
| -200,95
| -162,24
| 240,04
|
| CН3ОH (ж)
| -239,61
| -167,20
| 126,69
|
| C2H5OH (г)
| -234,75
| -168,18
| 282,60
|
| C2H5OH (ж)
| -276,9
| -174,3
| 161,1
|
| СО (г)
| -110,6
| -137,2
| 197,7
|
| COC12 (г)
| -220,3
| -266,9
| 283,91
|
| СО2 (г)
| -393,8
| -394,6
| 213,8
|
| СO32- (р)
| -676,3
| -528,1
| -54,9
|
| CS2 (ж)
| 88,8
| 64,5
| 151,1
|
| HCN (ж)
| -109,6
| -125,6
| 113,2
|
| Н2СО3 (р)
| -699,5
| -619,2
| 187,4
|
| СНзСОО- (р)
| -488,87
| -372,99
| -
|
| Са (к)
|
|
| 45,45
|
| СаС2 (к)
| -59,9
| -64,9
| 70,0
|
| СаСО3 (к)
| -1207,7
| -1129,6
| 91,6
|
| CaCI2 (к)
| -796,3
| -748,9
| 104,7
|
| СаF2 (к)
| -1220,5
| -1168,1
| 68,9
|
| СаО (к)
| -635
| -603,6
| 39,7
|
| СаН2 (к)
| -188,7
| -149,8
| 42,0
|
| Са(ОН)2 (к)
| -986,8
| -899,2
| 83,4
|
| CaSO4 (к)
| -1424,0
| -1320,3
| 106,7
|
| СаSО4.2Н2О(гипс,к)
| -2023,98
| -1798,7
| 194,3
|
| Cd (к)
|
|
| 51,77
|
| СdСО3 (к)
| -754,6
| -674,5
| 96,7
|
| CdCI2 (к)
| -390,8
| -343,2
| 115,27
|
| CdO (к)
| -260,0
| -229,3
| 54,8
|
| Сd(ОН)2 (к)
| -561,5
| -473,8
| 93,04
|
| CdS (к)
| -156,9
| -153,2
| 71,1
|
| CdSО4 (к)
| -934,4
| -823,9
| 123,05
|
| СI (г)
| 121,3
| 105,3
| 165,1
|
| Сl- (р)
| -167,2
| -131,4
| 56,6
|
| Вещество
| DH  ,кДж/моль ,кДж/моль
| DG  ,кДж/моль ,кДж/моль
| S  ,Дж/моль.К ,Дж/моль.К
|
| CI2 (г)
|
|
| 222,9
|
| Сl2О (г)
| 75,7
|
| 266,2
|
| НСl (г)
| -92,4
| -94,5
| 186,9
|
| НСl (р)
| -166,9
| -131,2
| 56.5
|
| НСlO4 (ж)
| -34,5
| 84,0
| 188,4
|
| Со (к)
|
|
| 30,1
|
| СоСО3 (к)
| -722,6
| -651.0
| -
|
| СоСl2 (к)
| -310,2
| -267,5
| 109,7
|
| Со(NОЗ)2 (к)
| -421,8
| -243,3
|
|
| СоО (к)
| -239,7
| -215,2
| 52,8
|
| Со(ОН)2 (к)
| -541,0
| -456,1
| 82,0
|
| Со(ОН)з (к)
| -726,0
| -596,8
|
|
| CoS (к)
| -84,5
| -96,1
| -
|
| CoS04 (к)
| -889,5
| -783,7
| 117,5
|
| Сr (к)
|
|
| 23,6
|
| Cr2+ (р)
| -139
| -183,4
| 41,9
|
| СrЗ+ (р)
| -236,1
| -223,2
| -215,9
|
| CrC12 (к)
| -395,7
| -356,6
| 115,7
|
| СгСlз (к)
| -570,3
| -501,0
| 124,8
|
| СгОз (к)
| -590,8
| -513,8
| 72,3
|
| Cr(OH)2 (к)
| -669,0
| -576,1
| 81,2
|
| Сг(ОН)з (к)
| -995
| -846,8
| 95,4
|
| Сr2O3 (к)
| -1141.3
| -1059,7
| 81,2
|
| CrO2 (к)
| -590
| -540
| 48,1
|
| Сг2(SО4)З (к)
| -3308
| -2986
| 287,9
|
| (NH4)2Cr2O7 (к)
| -1801,7
| -
| -
|
| Cs (к)
|
|
| 84,35
|
| CsOH (к)
| -406,7
| -362,3
| 93,3
|
| Cs2O (к)
| -317,6
| -274,5
| 123,8
|
| Сu (к)
|
|
| 33,2
|
| Сu2+ (р)
| 66,0
|
| -92,8
|
| СuСО3 (к)
| -595,4
| -518,3
|
|
| CuCl (к)
| -137,5
| -120,1
| 87,0
|
| CuC12 (к)
| -215,7
| -171,5
| 108,2
|
| CuI2 (к)
| -21,3
| -23,8
| 159,0
|
| Сu(NОЗ)2 (к)
| -305,3
| -117
|
|
| СuО (к)
| -162,1
| -129,5
| 42,73
|
| Вещество
| DH  ,кДж/моль ,кДж/моль
| DG  ,кДж/моль ,кДж/моль
| S  ,Дж/моль.К ,Дж/моль.К
|
| Сu(ОН)2 (к)
| -444,6
| -359,6
|
|
| (СuОН)2CO3 (к)
| -1051
| -900,9
| 211,6
|
| CuS (к)
| -53,2
| -53,6
| 66,5
|
| Cu2S (к)
| -79,5
| -86,3
|
|
| CuSO4 (к)
| -771,4
| -662,2
| 109,3
|
| Сu2O (к)
| -173,3
| -150,6
| 92,99
|
| F2 (г)
|
|
| 202,9
|
| HF (г)
| -270,9
| -272,99
| 173,8
|
| Fe (к)
|
|
| 27,2
|
| Fe2+ (р)
| -87,2
| -78,96
| -110,9
|
| Fe3+ (р)
| -46,4
| -4,5
| -309,2
|
| FеСО3 (к)
| -738,6
| -665,5
| 95,5
|
| Fe(CO)5(г)
| -764,0
| -695,2
|
|
| FeC12 (к)
| -341,98
| -302,6
| 118,1
|
| FеС13 (к)
| -399,7
| -334,2
| 142,4
|
| FeO (к)
| -265,0
| -244,5
| 60,8
|
| Fe(OH)2 (к)
| -562,1
| -480,1
|
|
| Fе(ОН)з (к)
| -827,2
| -700,1
|
|
| FeS (к)
| -100,5
| -100,8
| 60,3
|
| FeS2 (к)
| -163,3
| -151,9
| 52,96
|
| FeSO4 (к)
| -929,5
| -825,5
| 121,0
|
| Fе2О3 (к)
| -822,7
| -740,8
| 87,5
|
| Fе2(SО4)З (к)
| -2582,0
| -2254,6
| 283,0
|
| FезС (к)
|
| 18,8
|
|
| FеЗО4 (к)
| -1117,9
| -1014,8
| 146,3
|
| Ga (к)
|
|
| 41,1
|
| Gа(ОН)3 (к)
| -1014,6
| -831,78
| 84,9
|
| Gа2О3 (к)
| -1089
| -998,2
| -
|
| Gе (к)
|
|
| 31,1
|
| GеО (к)
| -255
| -226,8
| 50,2
|
| GеО2 (к)
| -554,7
| -500,8
| 55,27
|
| Н (г)
| 217,98
| 203,3
| 114,6
|
| Н+ (р)
|
|
|
|
| Н2 (г)
|
|
| 130,7
|
| Нg (ж)
|
|
| 75,90
|
| HgCI2 (к)
| -228,2
| -180,9
| 140,02
|
| HgO (к)
| -90,9
| -58,6
| 70,29
|
| Вещество
| DH  ,кДж/моль ,кДж/моль
| DG  ,кДж/моль ,кДж/моль
| S  ,Дж/моль.К ,Дж/моль.К
|
| HgS (к)
| -59,0
| -56,9
| 105,4
|
| HgS04 (к)
| -707,9
| -589,0
| 136,4
|
| Нg2С12 (к)
| -265,1
| -210,8
| 192.8
|
| Hg2O (к)
| -
| -63,3
| 130,6
|
| Hg2SO4 (к)
| -744,7
| -627,5
| 200,7
|
| I2 (г)
| 62,3
| 19,2
| 260,6
|
| I- (р)
| -55,9
| -51,7
| 109,4
|
| I2 (к)
|
|
| 116,5
|
| НI (г)
| 26,57
| 1,78
| 206,48
|
| НI (p)
| -55,2
| -51,5
| 111,3
|
| К (к)
|
|
| 71,45
|
| К+ (р)
| -251,2
| -282,3
| 102,5
|
| КВг (к)
| -392,5
| -378,8
| 95,85
|
| KCN (к)
| -112,5
| -103,9
| 137,03
|
| К2СО3 (к)
| -1146,1
| -1059,8
| 156.32
|
| КСl (к)
| -439,5
| -408,0
| 82,56
|
| KF (к)
| -567,4
| -537,7
| 66,60
|
| KI (к)
| -327,6
| -324,1
| 110,79
|
| КМnО4 (к)
| -813,4
| -713,8
| 171,71
|
| KNО2 (к)
| -370,3
| -281
| 117,1
|
| КNО3 (к)
| -493,2
| -393,1
| 132,93
|
| КОН (к)
| -425,8
| -380,2
| 79,32
|
| КОН (р)
| -477,3
| -440,5
| 91,6
|
| К2СrО4 (к)
| -1382,8
| -1286,0
| 193,3
|
| К2Сr2O7 (к)
| -2033,0
| -1866
| 291,2
|
| К2O (к)
| -363,2
| -323,1
| 94,1
|
| К2О2 (к)
| -495.8
| -429,8
| 113,0
|
| K2S (к)
| -428,4
| -404,2
| 111,3
|
| K2SO4 (к)
| -1433,7
| -1316,4
| 175,7
|
| Li (к)
|
|
| 28,6
|
| LiCl (к)
| -408,3
| -384,0
| 59,3
|
| LiOH (к)
| -487,2
| -442,2
| 42,8
|
| Li2О (к)
| -595,8
| -562,1
| 37,87
|
| Mg (к)
|
|
| 32,7
|
| Mg2+ (p)
| -467
| -455,1
|
|
| MgBr2 (к)
| -517,6
| -472
| 125,6
|
| МgСОз (к)
| -1013
| -1029,3
| 65,7
|
| Вещество
| DH  ,кДж/моль ,кДж/моль
| DG  ,кДж/моль ,кДж/моль
| S  ,Дж/моль.К ,Дж/моль.К
|
| MgCI2 (к)
| -641,1
| -591,6
| 89,8
|
| MgF2 (к)
| -1113
| -1071
| 57,2
|
| MgO (к)
| -601,8
| -569,6
| 26,9
|
| Mg(OH)2 (к)
| -924,7
| -833,7
| 63,14
|
| Мg2С3 (к)
| -79,5
| -83
| 92,1
|
| MgSO4 (к)
| -1301,4
| -1158,7
| 91,6
|
| MgS (к)
| -347,0
| -362,0
| 50,3
|
| Mn (к)
|
|
| 32,0
|
| МnСОз (к)
| -881,7
| -811,4
| 109,5
|
| MnCI2 (к)
| -481,2
| -440,4
| 118,2
|
| MnO (к)
| -385,1
| -363,3
| 61,5
|
| МnЗО4 (к)
| -1387,5
| -1282
| 148,6
|
| MnО2 (к)
| -521,5
| -466,7
| 53,1
|
| Mn(OH)2 (к)
| -700
| -618,7
| 94,9
|
| MnSO4 (к)
| -1066,7
| -959,0
| 112,5
|
| Mn2O7 (к)
| -726,3
| -543,9
| -
|
| Mo (к)
|
|
| 28,6
|
| MoО2 (к)
| -586,1
| -533,2
| 46,28
|
| МоО3 (к)
| -745,2
| -668,1
| 77.74
|
| N2 (г)
|
|
| 199,9
|
| NН2ОН (р)
| -98,3
| -23,4
| 167,4
|
| NН3 (г)
| -46,19
| -16,7
| 192,6
|
| NН4+ (p)
| -132,4
| -79,5
| 114,4
|
| NН4Cl (к)
| -314,4
| -204,3
| 95,9
|
| NН4NОз (к)
| -365,4
| -183,9
| 151,1
|
| (NH4)2SO4 (к)
| -1181,1
| -901,9
|
|
| NO (г)
| 90,31
| 80,6
| 210,7
|
| NО2 (г)
|
| 51,5
| 240,2
|
| NО3- (р)
| -207,5
| -111,7
| 147,3
|
| N2O (г)
| 82,1
| 104,2
| 220,0
|
| N2О3 (г)
| 83,3
| 140,6
| 307,3
|
| N2О4 (ж)
| 19,05
| 98,0
| 209.3
|
| N2О4 (г)
| 9,37
| 98,29
| 304,3
|
| N2O5 (г)
| 11,31
| 115,22
| 356,15
|
| N2O5 (к)
| -43,16
| 113,97
| 178,49
|
| НNО2 (p)
| -119,2
| -55,6
| 152,7
|
| Вещество
| DH  ,кДж/моль ,кДж/моль
| DG  ,кДж/моль ,кДж/моль
| S  ,Дж/моль.К ,Дж/моль.К
|
| НNО3 (ж)
| -174,3
| -80,9
| 155,7
|
| НNО3 (г)
| -135,1
| -74,8
| 266,9
|
| Na (к)
|
|
| 51,45
|
| Na+ (р)
| -239,9
| -262,13
| 58,91
|
| NaCN (к)
| -89,8
| -80,4
| 118,5
|
| NaCI (к)
| -411,1
| -384,0
| 72,12
|
| NaNО2 (к)
| -359
| -295
|
|
| NаNО3 (к)
| -466,7
| -365,9
|
|
| NaOH (к)
| -425,6
| -380,7
| 64,4
|
| NaOH (р)
| -470
| -419,2
| 48,1
|
| Nа2СОЗ (к)
| -1137,5
| -1047,5
| 136,4
|
| Na2О (к)
| -510,8
| -376,1
| 72,4
|
| Na2S (к)
| -370,3
| -354,8
| 77,4
|
| Nа2SО3 (к)
| -1090
| -1002
| 146,0
|
| Na2SО4 (к)
| -1384,6
| -1266,8
| 149,5
|
| NаЗРО4 (к)
| -1935,5
| -1819
| 224,7
|
| Na2PbО2 (к)
| -704,3
| -742
|
|
| Ni (к)
|
|
| 29,9
|
| NiCI2 (к)
| -304,2
| -258,0
| 98,07
|
| Ni(ОН)3 (к)
| -600,7
| -540,3
|
|
| NiO (к)
| -239,7
| -211,6
| 37,9
|
| Ni(OH)2 (к)
| -543,5
| -458,4
| 79,9
|
| NiS (к)
| -79
| -76,9
| 52,97
|
| NiSО4 (к)
| -873,5
| -763,8
| 103,9
|
| О (г)
| 246,8
| 231,8
| 160,9
|
| О2 (г)
|
|
| 205,0
|
| О3 (г)
| 142,3
| 162,7
| 238,8
|
| ОН- (р)
| -230,2
| -157,4
| -10,8
|
| Н2О (г)
| -241,98
| -228,8
| 188,9
|
| Н2О (ж)
| -286,0
| -237,4
| 70,0
|
| Н2О2 (ж)
| -187,9
| -120,5
| 109,6
|
| Р (белый, к)
|
|
| 41,1
|
| Р (красный, к)
| -17,6
| -12, 13
| 22,8
|
| РСl3 (г)
| -287,02
| -260,5
| 3] 1,7
|
| PCl5 (г)
| -374,89
| -305,4
| 364,5
|
| РН3 (г)
| 5,44
| 13,39
| 210,1
|
| Вещество
| DH  ,кДж/моль ,кДж/моль
| DG  ,кДж/моль ,кДж/моль
| S  ,Дж/моль.К ,Дж/моль.К
|
| P2О5 (г)
| -2093
| -1943
|
|
| P2О5 (к)
| -1506,24
| -1363,98
| 135,98
|
| НЗРО4 (ж)
| -1271,94
| -1138,0
| 201,87
|
| Н3РО4 (к)
| -1283,65
| -1139,7
| 176,2
|
| НРО3 (р)
| -983,81
| -904,20
| 150,84
|
| Рb (к)
|
|
| 64,8
|
| РЬСО3 (к)
| -700,0
| -626,29
| 131,0
|
| PbCI2 (к)
| -360,9
| -315,62
| 136,0
|
| РbО (к)
| -219,4
| -186,2
| 66,2
|
| РЬО2 (к)
| -276,75
| -218,45
| 71,97
|
| PbS (к)
| -100,4
| -98,8
| 91,2
|
| PbSО4 (к)
| -912
| -814,3
| 148,67
|
| РbЗО4 (к)
| -723,9
| -606,58
| 211,4
|
| S (монокл., к)
| 0,38
| 0,188
| 32,6
|
| S (ромб., к)
|
|
| 31,9
|
| SО2 (г)
| -297,2
| -300,41
| 248,2
|
| SОЗ (г)
| -376,2
| -370
| 256,4
|
| H2S (ж)
| -20,1
| -33,0
| 205,6
|
| Н2SО4 (ж)
| -814
| -690,7
| 157,0
|
| Se (к)
|
|
| 42,2
|
| H2Se (г)
| 33,0
| 19,72
| 218,97
|
| Si (к)
|
|
| 18,8
|
| SiC (к)
| -73,3
| -70,9
| 16,62
|
| SiCI4 (ж)
| -664,8
| -598,3
| 252,6
|
| SiH4 (г)
| 30,6
| 53,2
| 204,7
|
| SiO (к)
| -454,62
| -
| -
|
| SiО2 (к)
| -911,6
| -857,2
| 41,9
|
| SiО2 (ж)
| -904,82
| -852,0
| 47,01
|
| Sn (белое, к)
|
|
| 51,6
|
| Sn (серое, к)
| -2,1
| -0,13
| 44,2
|
| Sn2+ (р)
| -10,5
| -27,3
| -22,7
|
| Sn4+ (р)
| -2,43
| -2,4
| -226,1
|
| SnCl4 (ж)
| -529,2
| -458,1
|
|
| SnН4 (г)
| 16,3
| 187,8
| 228,7
|
| SnO (к)
| -286,2
| -258,1
|
|
| Sn(ОН)2 (к)
| -506,3
| -491,6
| 87,7
|
| SnО2 (к)
| -581,2
| -520,2
|
|
| Вещество
| DH  ,кДж/моль ,кДж/моль
| DG  ,кДж/моль ,кДж/моль
| S  ,Дж/моль.К ,Дж/моль.К
|
| SnS (к)
| -110,2
| -108,3
| 77,0
|
| SnS2 (к)
| -82,5
| -74,1
| 87,5
|
| Н2Те (г)
| 154,39
| 138,49
| 234,30
|
| Ti (к)
|
|
| 30,6
|
| TiC (к)
| -186,2
| -182,6
| 24,3
|
| TiC12 (к)
| -516,7
| -472,7
| 105,9
|
| ТiСl3 (к)
| -721,0
| -654,1
| 139,7
|
| TiCl4 (г)
| -763,2
| -726,1
| 352,2
|
| TiCl4 (ж)
| -804,6
| -737,7
| 252,3
|
| ТiI4 (г)
| -284,5
| -381,9
|
|
| TiO (к)
| -518,4
| -489,1
| 34,9
|
| TiО2 (к)
| -943,5
| -888,2
| 50,2
|
| Тi2О3 (к)
| -1520,5
| -1434,1
| 78,8
|
| ТlОН (к)
| -233,5
| -190,6
| 255,2
|
| Тl(ОН)3 (к)
| -516,6
| -
| 102,1
|
| Т12О (к)
| -167,4
| -153,1
| 161,1
|
| Т12О3 (к)
| -390,4
| -321,4
| 148,1
|
| Zn (к)
|
|
| 41,66
|
| Zn2+ (p)
| -153,74
| -147,26
| -110,67
|
| ZnСОз(к)
| -818,59
| -737,3
| 82,5
|
| ZnCI2 (к)
| -415,33
| -369,6
| 111,54
|
| ZnO (к)
| -350,8
| -320,88
| 43,67
|
| Zn(ОН)2 (к)
| -644
| -554,79
| 76,15
|
| ZnS (к)
| -205,6
| -200,85
| 57,78
|
14. КОНСТАНТЫ ДИССОЦИАЦИИ КИСЛОТ В ВОДНЫХ РАСТВОРАХ
| Кислота
| Формула
| Кдис
|
| Азотистая
| HNO2
| 4∙10-4
|
| Азотистоводородная
| НN3
| 2,6 ∙10-5
|
| Азотная
| HNO3
| 4,36∙10
|
| Алюминиевая (мета)
| HAIO2
| 6∙10-13
|
| Борная (мета)
| HBO2
| 7,5∙10-10
|
|
Борная (орто)
| Н3ВО3
| (I) 5,8∙10-10
(II) 1,8∙10-13
(III) 1,6 ∙10-14
|
| Кислота
| Формула
| Кдис
|
| Бромоводородная
| HBr
| 1 ∙109
|
| Бромноватая
| HВrO3
| 2∙10-1
|
| Бромноватистая
| HBrO
| 2,06 ∙10-9
|
| Водорода пероксид
| H2О2
| (I) 2,63 ∙10-12
(II) 1,0∙10-25
|
| Галлия гидроксид
| H3GaO3
| (II) 5∙10-11
(III) 2∙10-12
|
| Германиевая
| H2GeO3
| (I) 1,7∙10-9
(II) 1,9∙10-13
|
| Дитионистая
| H2S2O4
| (I) 5∙10-1
(II) 4∙10-3
|
| Железистосинеродистая
| H4[Fe(CN)6]
| (III) 1,0∙10-3
(IV) 5,6 ∙10-2
|
| Иодоводородная
| HI
| 1∙1011
|
|
Иодная (орто)
| H5IO6
| (I) 3,09∙1012
(II) 7,08∙10-9
(III) 2,5∙10-13
|
| Йодная (мета)
| H1О3
| 1,7∙10-1
|
| Кремниевая (мета)
| H2SiO3
| (I) 2,2∙10-10
(II) 1,6∙10-12
|
| Марганцовая
| HМnО4
| 2∙102
|
| Молибденовая
| H2MoО4
| (II) 1∙10-6
|
|
Мышьяковая (орто)
| H3AsО4
| (I) 5,9810-3
(II) 1,05∙10-7
(III) 3,89∙10-12
|
| Мышьяковистая (орто)
| H3AsО3
| (I) 6∙10-10
(II) 1,7∙10-14
|
| Мышьяковистая (мета)
| HasО2
| 6∙10-10
|
| Оловянистая
| Н2SnO2
| 6∙10-18
|
| Оловянная
| H2SnО3
| 4∙10-10
|
| Родановодородная
| HSCN
| 1,4∙10-1
|
|
Пирофосфорная
| Н4Р2О7
| (I) 1,4∙10-1
(II) 1,1∙10-2
(III) 2,1∙10-7
(IV) 4,1∙10-10
|
| Кислота
| Формула
| Кдис
|
| Свинцовистая
| H2PbO2
| 2∙10-16
|
| Селенистая
| H2SeO3
| (I)3,5∙10-3
(II) 5,0∙lO-8
|
| Селеноводородная
| H2Se
| (I)1,7∙10-4
(II) 1,0∙10-11
|
| Селеновая
| H2SeO4
| (I) 1,0∙103
(II) 1,2∙10-2
|
| Серная
| H2SO4
| (I)1∙103
(II) 1,2∙10-2
|
| Сернистая
| H2SO3
| (I)1,58∙10-2
(II) 6,31∙10-8
|
| Сероводородная
| H2S
| (I)6∙10-8
(II) 1∙10-14
|
| Сурьмяная (орто)
| H3SbO4
| 4∙10-5
|
| Сурьмянистая (мета)
| HSbO2
| 1∙10-11
|
| Теллуристая
| H2TeO3
| (I)3∙10-3
(II) 2∙10-3
|
| Теллуроводородная
| H2Te
| 1∙10-8
|
| Теллуровая
| H2TeO4
| (I)2,29 ∙10-8
(II) 6,46∙10-12
|
| Тетраборная
| H2B4O7
| (I)1,8∙10-4
(II) 1,5∙10-5
|
| Тиосерная
| H2S2О3
| (I)2,2∙10-1
(II) 2,8∙10-2
|
| Угольная
| H2CО3
| (I)4,45∙10-7
(II) 4,69∙10-11
|
| Фосфористая(орто)
| H3PО3
| (I)1,6∙10-3
(II) 6,3∙10-7
|
|
Фосфорная (орто)
| H3PO4
| (I)7,52∙10-3
(II) 6,31∙10-8
(III) 1,26∙10-12
|
| Фосфорноватистая
| H3PO2
| 7,9 ∙10-2
|
| Фтороводородная
| HF
| 6,61∙10-4
|
| Хлористая
| HCIO2
| 5∙10-3
|
| Хлороводородная(соляная)
| HC1
| 1 ∙107
|
| Кислота
| Формула
| Кдис
|
| Хлорноватистая
| HC1О
| 5,01∙l0-8
|
| Хромовая
| H2CrO4
| (I) 1,8∙10-1
(II) 3,16∙10-7
|
| Циановодородная
| HCN
| 7,9∙I0-10
|
| Муравьиная
| HCOOH
| 1,77∙10-4
|
| Уксусная
| CH3COOH
| 1,75∙10-5
|
15. КОНСТАНТЫ ДИССОЦИАЦИИ НЕОРГАНИЧЕСКИХ ОСНОВАНИЙ В ВОДНЫХ РАСТВОРАХ
| Основание
| Формула
| Кдис
|
| Гидроксид
| | |
| алюминия
| A1(OH)3
| (III) 1,38∙10-9
|
| аммония
| NH4ОH
| 1.79∙10-5
|
| бария
| Ba(OH)2
| 2,3∙10-1
|
| галлия
| Ga(OH)3
| (II) 1,6∙10-11
(III) 4∙10-12
|
| железа (II)
| Fe(OH)2
| (II) 1,3∙10-4
|
| железа (III)
| Fe(OH)3
| (II) 1,82∙10-11
(III) 1,35∙10-12
|
| кадмия
| Cd(OH)2
| (II) 5,0∙10-3
|
| кальция
| Ca(OH)2 |




 Сродство к электрону взято с обратным знаком, т.е. приведены первые энергии ионизации отрицательно заряженных ионов Э-
Сродство к электрону взято с обратным знаком, т.е. приведены первые энергии ионизации отрицательно заряженных ионов Э-

 11. ТИПЫ МЕЖМОЛЕКУЛЯРНЫХ ВЗАИМОДЕЙСТВИЙ
11. ТИПЫ МЕЖМОЛЕКУЛЯРНЫХ ВЗАИМОДЕЙСТВИЙ ,кДж/моль
,кДж/моль
 ,кДж/моль
,кДж/моль
 ,Дж/моль.К
,Дж/моль.К
 ,кДж/моль
,кДж/моль
 ,кДж/моль
,кДж/моль
 ,Дж/моль.К
,Дж/моль.К
 ,кДж/моль
,кДж/моль
 ,кДж/моль
,кДж/моль
 ,Дж/моль.К
,Дж/моль.К
 ,кДж/моль
,кДж/моль
 ,кДж/моль
,кДж/моль
 ,Дж/моль.К
,Дж/моль.К
 ,кДж/моль
,кДж/моль
 ,кДж/моль
,кДж/моль
 ,Дж/моль.К
,Дж/моль.К
 ,кДж/моль
,кДж/моль
 ,кДж/моль
,кДж/моль
 ,Дж/моль.К
,Дж/моль.К
 ,кДж/моль
,кДж/моль
 ,кДж/моль
,кДж/моль
 ,Дж/моль.К
,Дж/моль.К
 ,кДж/моль
,кДж/моль
 ,кДж/моль
,кДж/моль
 ,Дж/моль.К
,Дж/моль.К
 ,кДж/моль
,кДж/моль
 ,кДж/моль
,кДж/моль
 ,Дж/моль.К
,Дж/моль.К
 ,кДж/моль
,кДж/моль
 ,кДж/моль
,кДж/моль
 ,Дж/моль.К
,Дж/моль.К
 2015-09-07
2015-09-07 391
391







