Продолжение табл. 17
|
|
|
|
|
| +3I2+3H2O
| Реакция замедлена
|
| Вr2, С12
| Cl2 + 2I– =2Cl–+I2
| To же
|
| O2
| O2 + 4Mn(OH)2 + 2H2О = = 4Мn(ОН)3
2Мn(ОН)3 + 6H+ + 2I– = =2Мn2+ + I2 + 6Н2О
| Добавление Мn2+ и NaOH, затем подкисление 2 моль/л НС1 до рН=4–5, введение KI
|
| Н2О2
| H2O2 + 2I– + 2H+ =
= 2H2O + I2
| Среда – 1 моль/л H2SO4, катализатор – NH4MoO3
|
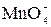
| 2 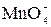 + 10I– + 16Н+ = = 2Mn2+ + 5I2 + 8H2O + 10I– + 16Н+ = = 2Mn2+ + 5I2 + 8H2O
| Среда – 0,1 моль/л H2SO4
|
| МnО2
| МnО2 + 2I– + 4Н+ =
= Mn2+ + I2 + 2H2O
| Среда – 0,5 моль/л Н3РО4
|
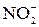
| 2 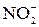 + 2I– + 4Н+ =
= 2NO + I2 + 2H2O + 2I– + 4Н+ =
= 2NO + I2 + 2H2O
| Среда – 1 моль/л H2SO4
|
| Fe3+
| 2Fe3+ + 2I– = 2Fe2+ + I2
| Среда – конц. раствор НС1, реакция замедлена
|
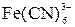
| 2 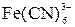 +2I– = =2 +2I– = =2 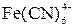 + I2 + I2
| Среда – 1 моль/л НС1
|
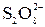
| 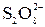 +2I– = 2 +2I– = 2 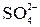 + I2 + I2
| Среда нейтральная, перед титрованием подкислить раствором HCl
|
| Pb2+, Ba2+, Sr2+
| М2++ 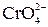 = ↓MCrO4
2MCrO4 + 2H+ = 2M2+ + = ↓MCrO4
2MCrO4 + 2H+ = 2M2+ + 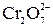 + H2O + H2O
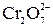 +6I– + 14H+ =2Cr3+ + 3I2 + 7H2O +6I– + 14H+ =2Cr3+ + 3I2 + 7H2O
| Осадок МСrО4 растворяют в 2 моль/л НС1 в присутствии избытка КI
|
| RCOOH
(карбоновые
кислоты)
| 6R-COOH+ 5KI +KIO3 = = 6R-СООК + 3I2 + + 3Н2О
| В присутствии избытка I– и 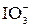
|
| Обратное титрование
|
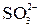
| 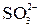 + I2(изб) + H2O = = + I2(изб) + H2O = = 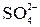 + 2I– + 2H+ +(I2)ост + 2I– + 2H+ +(I2)ост
| Остаток I2 в слабокислой среде титруют раствором Na2S2O3
|
Окончание табл. 17
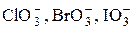
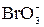 + 6I– + 6H+ =Br– +
+ 6I– + 6H+ =Br– +
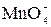
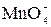 + 10I– + 16Н+ = = 2Mn2+ + 5I2 + 8H2O
+ 10I– + 16Н+ = = 2Mn2+ + 5I2 + 8H2O
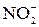
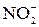 + 2I– + 4Н+ =
= 2NO + I2 + 2H2O
+ 2I– + 4Н+ =
= 2NO + I2 + 2H2O
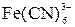
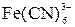 +2I– = =2
+2I– = =2 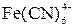 + I2
+ I2
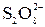
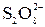 +2I– = 2
+2I– = 2 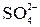 + I2
+ I2
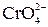 = ↓MCrO4
2MCrO4 + 2H+ = 2M2+ +
= ↓MCrO4
2MCrO4 + 2H+ = 2M2+ + 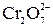 + H2O
+ H2O
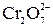 +6I– + 14H+ =2Cr3+ + 3I2 + 7H2O
+6I– + 14H+ =2Cr3+ + 3I2 + 7H2O
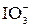
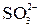
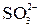 + I2(изб) + H2O = =
+ I2(изб) + H2O = = 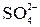 + 2I– + 2H+ +(I2)ост
+ 2I– + 2H+ +(I2)ост
 2015-09-06
2015-09-06 368
368








