| Определяемое соединение (ион) | Реакции, используемые в ходе анализа | Условия проведения анализа |
| Sn2+ | 5Sn2++2 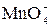 + 16H+ =
= 5Sn4++2Mn2++8H2O + 16H+ =
= 5Sn4++2Mn2++8H2O
| Среда – 1 моль/л H2SO4, исключить доступ O2 |
| Вr– | 10Br– +2 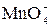 + 16H+ =
= 2Мn2+ +8Н2О + 5Вr2 + 16H+ =
= 2Мn2+ +8Н2О + 5Вr2
| Титрование в 2 моль/л H2SO4 при кипячении для удаления Br2 |
| CH3OH | СН3ОН + 6 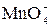 +8OH– = = +8OH– = = 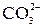 + 6 + 6 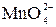 +
+ 6H2O +( +
+ 6H2O +(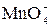 )ост )ост  2(
2(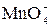 )ост + НСОО– +
+ 3Ba2+ + 3ОН– =
=↓2ВаМnО4 + BaCO3 + 8H2O )ост + НСОО– +
+ 3Ba2+ + 3ОН– =
=↓2ВаМnО4 + BaCO3 + 8H2O
| Обратное титрование. Остаток непрореагировавшего
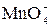 после добавления соли бария титруют раствором формиата натрия после добавления соли бария титруют раствором формиата натрия
|
| HCOOH | HCOO– + 2 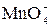 + 3OH–= = + 3OH–= = 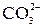 + 2 + 2 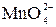 +
+ 2H2O+( +
+ 2H2O+(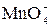 )ост
3 )ост
3 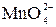 + 4H+ = MnO2 + +2 + 4H+ = MnO2 + +2 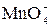 + 2H2O
1)5 + 2H2O
1)5 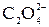 +2 +2 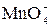 +16H+ =
= 10CO2 + 2Mn2+ +8H2O
5 +16H+ =
= 10CO2 + 2Mn2+ +8H2O
5 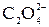 +2MnO2+16H+ = = 10CO2 + 2Mn2+ +8H2O
5 +2MnO2+16H+ = = 10CO2 + 2Mn2+ +8H2O
5 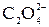 +2 +2 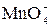 +16H+ = = 10CO2 + 2Mn2+ +8H2O +16H+ = = 10CO2 + 2Mn2+ +8H2O
| Реакцию проводят в щелочной среде. После подкисления раствора происходит диспропорционирование 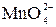 . Далее возможны варианты:
1) при нагревании проводят реакцию с . Далее возможны варианты:
1) при нагревании проводят реакцию с 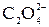 до полного осветления раствора. Избыток до полного осветления раствора. Избыток 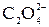 титруют раствором KMnO4; титруют раствором KMnO4;
|
Окончание табл. 16
2) 2 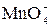 + 10I– + 16Н+ = = 2Mn2+ + 5I2 + 8H2O
МnО2 + 2I– + 4Н+ =
= Mn2+ + I2 + 2H2O + 10I– + 16Н+ = = 2Mn2+ + 5I2 + 8H2O
МnО2 + 2I– + 4Н+ =
= Mn2+ + I2 + 2H2O
| 2) проводят иодометрическое определение избытка KMnO4 | |
| Ca2+, Mg2+, Zn2+, Co2+, La3+, Th4+, Ba2+, Sr2+, Pb2+, Ag+ | M2++ 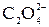 изб =↓MC2O4 + + изб =↓MC2O4 + + 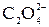 ост
5 ост
5 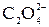 +2 +2  +16H+ =
= 10CO2 + 2Mn2+ +8H2O
M2++ +16H+ =
= 10CO2 + 2Mn2+ +8H2O
M2++ 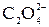 изб =↓MC2O4
MC2O4 + 2H+ = M2+ + H2C2O4
5 изб =↓MC2O4
MC2O4 + 2H+ = M2+ + H2C2O4
5 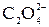 +2 +2 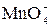 +16H+ = =10CO2 + 2Mn2+ +8H2O +16H+ = =10CO2 + 2Mn2+ +8H2O
| Осадок МС2О4 отделяют и отбрасывают, фильтрат и промывные воды титруют при 70–80оC раствором KMnO4 в среде 2 моль/л H2SO4. Осадок MC2O4 отделяют, промывают, растворяют в 2 моль/л H2SO4 и титруют, как указано выше |
Таблица 17. Условия проведения иодометрического опре-деления некоторых ионов и соединений
|
|
|
В этой таблице собраны основные сведения (реакции, условия их проведения, способы титрования), которые помогут выполнить иодометрическое определение некоторых катионов, анионов и соединений, в т. ч. органических.
Таблица 17
 2015-09-06
2015-09-06 256
256








