1 Поняття про металознавство.
2 Кристалічна будова металів.
3 Типи кристалічних граток.
4 Дефекти кристалічних граток.
5 Кристалізація металів.
6 Кристалізація заліза.
1. В усі часи майстри шукали способи зробити металеві вироби більш міцними, надійним, красивими і зручними в користуванні.
У 18 столітті на основі аналізу, попереднього досвіду і припущень стала зароджуватися наукова теорія, що пояснювала причини поломок виробів і показувала способи поліпшення якості металу. Творці наукової теорії вперше почали пов'язувати якість металів, його міцнісні властивості з особливостями його будови. Такий підхід в даний час є єдино правильним.
Металознавство - наука, що вивчає будову і властивості металів в їх строгому взаємозв'язку, а також закономірності змін властивостей під впливом теплової, механічної або хімічної дії.
Сучасна металозберігаюча технологія може бути реалізована не тільки в результаті пошуків прямих шляхів економії металів при виготовленні виробів, але і за рахунок істотного поліпшення його якості, завдяки чому може бути зменшена маса матеріалу, що витрачається.
2. Речовини в твердому стані мають кристалічну або аморфну будову. В ідеальній кристалічній речовині атоми розташовані за геометрично правильною схемою і на певній відстані один від одного, в аморфних же (склі, каніфолі) атоми розташовані безладно
Метали у твердому стані є тілами, що складаються з величезної кількості дрібних, помітних тільки в мікроскоп зерен - кристалітів. У свою чергу, ці зерна складаються з атомів, впорядковано розташованих один щодо одного в просторі. Розташовуючись у просторі, найближчі один до одного атоми утворюють контур якого-небудь геометричного тіла, наприклад куба (рис.1.1),т  обто кожне зерно металу складається з безлічі таких однаково орієнтованих геометричних тіл, званих елементарними комірками.
обто кожне зерно металу складається з безлічі таких однаково орієнтованих геометричних тіл, званих елементарними комірками.
Знаходячись у вузлах кристалічних граток, атоми коливаються щодо свого середнього положення з частотою близько 10 Гц, не покидаючи своїх місць.
Атом будь-якого металу складається з позитивно зарядженого ядра і оточуючого його несучих негативний заряд декількох електронних оболонок. На останній оболонці знаходиться декілька електронів, слабко пов'язаних з ядром. Їх число дорівнює валентності металів. Електрони зовнішніх оболонок атомів металів, звані валентними, легко відщеплюються, швидко рухаються між ядрами і називаються вільними. Внаслідок наявності вільних електронів атоми металів є позитивно зарядженими іонами.
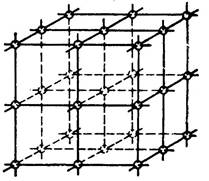
Рисунок 1.1
У вузлах кристалічних граток атоми металів зв'язуються зі своїми найближчими сусідами за допомогою валентних електронів. Зв'язок такого вигляду називається металевим.
Певна частина валентних електронів, покидаючи ядра своїх атомів, йде в міжвузловий простір і утворює так званий електронний «газ», що складається з таких же електронів, які втратили зв'язок зі своїми ядрами і стали загальними або колективізованими.
Завдяки колективізованим електронам метали володіють електро- і теплопровідністю, характерним металевим блиском і деякими іншими чисто металевими властивостями.
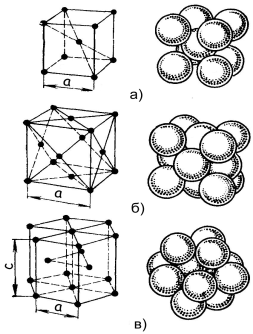
3. Тип кристалічної гратки металу визначається формою того геометричного тіла, яке складає основу його елементарної комірки. Найпоширенішими типами кристалічних граток металів є кубічна об'ємно центрована (ОЦК), кубічна гране центрована (ГЦК) і гексагональна щільноупакована (ГЩУ).
Як видно на рисунку 1.2, у обох типів кубічних граток по 8 атомів знаходиться у вершинах куба, а інші на перетині діагоналі - у ОЦК (рис. а), або на перетині кожної грані, тобто в її центрі у ГЦК (рис. б).
Комірка гратки ГЩУ (рис. 1.2, в) є призмою, основою якої є центровані одним атомом шестигранники. Всередині цієї комірки між основами знаходяться ще три атоми, створюючі рівносторонній трикутник.
Кристалічні гратки металів незалежно від їх типу є щільноупакованими. Це означає, що атоми, що знаходяться у вузлах, стикаються один з одним своїми зовнішніми оболонками.
ОЦК - гратки мають залізо за звичайних температурних умов, хром, вольфрам, ванадій, молібден, калій, натрій.
ГЦК - гратки мають нікель, мідь, алюміній, свинець, срібло, залізо при температурі 911 - 1392°С і ін.
ГЩУ - гратки мають магній, цинк, а так само кобальт, цирконій і титан при кімнатній температурі.
|
4. У реальних металів є ще одна дуже важлива для розуміння їх властивостей особливість. Кристалічна гратка їх зерен не є ідеальною геометричною побудовою, їй властиві такі дефекти, як вакансії, впроваджені атоми і дислокація.
Вакансією називається незаповнений із тієї або іншої причини вузол кристалічної гратки (рис. 1.3,а). В місцях вакансій кристалічна гратка викривлена, там виникають місцеві внутрішні напруги, які обумовлені порушеннями однорідності сил міжатомної взаємодії, існуючої в ідеальних кристалічних гратках зі всіма заповненими вузлами.
Якщо в окремих комірках кристалічної гратки між її вузлами з яких-небудь причин виявляються як би «зайві атоми» даного або іншого елемента, то створюючі при цьому дефекти атоми називаються впровадженими атомами. Внутрішні напруги виявляються тим більше, чим значніше різниця між розмірами атомів впровадженого і даного металу (рис. 1.3,б).
Лінійні недосконалості кристалічної гратки називаються дислокацією (рис. 1.3,в). Вони виникають при кристалізації, особливо на межах зерен при пластичній деформації металу, при різких нагрівах і охолоджуваннях. Ці дефекти представляють ніби зсув частини кристалічної гратки.
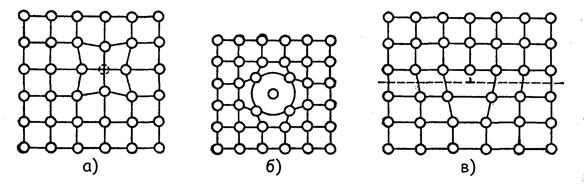
Рисунок 1.3
Дефекти кристалів роблять істотний вплив на механічні, фізичні, хімічні і технологічні властивості металів.
5. Кожна речовина залежно від температури і тиску може знаходитися в твердому, рідкому і газоподібному (пароподібному) стані.
Кристалізацією називається утворення кристалів у металах (і сплавах) при переході з рідкого стану в твердий (первинна кристалізація). До вторинної кристалізації відносять перетворення в затверділому металі при його охолодженні.
При затвердінні і при алотропічному перетворенні в металі спочатку виникають зародки кристала (центри кристалізації), навколо яких групуються атоми, утворюючи відповідну кристалічну гратку. Центрами кристалізації можуть служити неметалічні включення. Таким чином, процес кристалізації складається з двох етапів: утворення центрів кристалізації і зростання кристалів.
Властивості металів залежать так само від форми і розміру зерен, отже, дуже важливо знати, яким чином і за якими законами відбувається кристалізація металів і чи можна управляти розмірами зерен, щоб набувати необхідні властивості.
6.Ознайомимося з кривими нагрівання і охолоджування заліза і з'ясуємо їх фізичну сутність (рис.1.4).
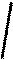 t °С Рідина
t °С Рідина
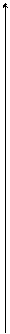 1600 __ Залізо
1600 __ Залізо
1539 __
1540 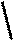


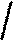 ОЦКd<=>З
ОЦКd<=>З
 1400 __ ОЦКd
1400 __ ОЦКd
 | |||
 |
ГЦКg<=> ОЦКd

 1200 __
1200 __
ГЦКg
1000 __






 ОЦК b<=> ГЦКg
ОЦК b<=> ГЦКg
 800 ___ ОЦКb
800 ___ ОЦКb




ОЦКa <=> ОЦКb
 ОЦК a
ОЦК a
600 __
 час
час
Рисунок 1.4
Як видно з ходу кривої нагрівання, при низьких температурах кристалічні гратки ОЦК зберігаються аж до 911°С, при цій температурі відбувається перебудова ОЦК комірок в ГЦК, що вимагає деяких витрат енергії. Цим пояснюється припинення зростання температури, не дивлячись на те, що поглинання металом теплоти, що нагрівається, продовжується.
Гратки ГЦК (g -Fe) існують до 1392°С, після чого вона під дією законів термодинаміки знову перебудовується в гратки ОЦК, які існують аж до температури плавлення 1539°С, тобто до руйнування кристалічних граток. На це і витрачається всятеплова енергія, що поступає в метал теплова енергія. (Температура не зростає до тих пір, поки не закінчиться руйнування граток).
Перехід заліза, як і деяких інших металів (Ti, Zn, Sn) з однієї форми в іншу відбувається внаслідок того, що, змінивши тип кристалічних граток, вони знижують запас вільної енергії.
Ділянка від 600° до 768° С означає перехід магнітного заліза з ОЦК-граткою (a-заліза) в немагнітне залізо (b -залізо) з тими ж гратками.
На кривій охолоджування відображений процес переходу заліза з рідкого стану в твердий, а так само перетворення, що відбуваються в ньому після кристалізації при подальшому охолоджуванні. Не дивлячись на охолоджування, тобто відведення з металу теплоти, при 1539°С температура не падає, а зберігається на досягнутому рівні. Якщо при даній температурі до металу теплота підводиться, то вона витрачається на руйнування кристалічних граток і тому температура не підвищуватиметься. Але якщо метал холоне, тобто теплота, що міститься в ньому, відводиться в зовнішнє середовище, і якщо досягнута температура протягом якогось часу не знижується, а підтримується на постійному рівні, то це повинне означати, що в металі відбувається якийсь процес, пов'язаний з виділенням теплоти.
Із зробленого розбору кривих нагріву і охолоджування заліза ясно, що сутність плавлення металу є руйнування його кристалічних граток на блоки, супроводжуване значним збільшенням кінетичної енергії його атомів, пов'язане із зростанням амплітудних коливань.
При затвердінні відбувається процес побудови кристалічних граток металу, під час якого різко зменшується енергія руху його атомів, що повільно скоюється. При цьому прихована теплота кристалізації, що виділяється, підтримує температуру постійної до вичерпання рідкої фази, тобто до кінця кристалізації.
 2015-09-06
2015-09-06 1983
1983








