Получим теперь термодинамические условия фазового перехода и фазового равновесия жидкости и пара. Пусть имеем две фазы вещества: жидкое (1) и газообразное (2). Термодинамический потенциал Гиббса такой двухфазной системы будет 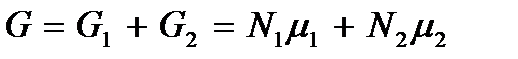 , где
, где 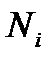 – число частиц в i -ой фазе (i = 1,2), а μi – термодинамический потенциал Гиббса, приходящийся на одну частицу i -ой фазы; эта величина характеризует внутренние свойства фазы и представляет собой ее химический потенциал.
– число частиц в i -ой фазе (i = 1,2), а μi – термодинамический потенциал Гиббса, приходящийся на одну частицу i -ой фазы; эта величина характеризует внутренние свойства фазы и представляет собой ее химический потенциал.
Если две фазы не находятся в равновесии друг с другом, то число частиц в обеих фазах будет изменяться. При изменении числа частиц в первой фазе на 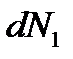 , а во второй на
, а во второй на 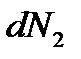 термодинамический потенциал системы изменится на
термодинамический потенциал системы изменится на 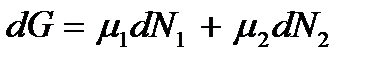 . Но так как
. Но так как 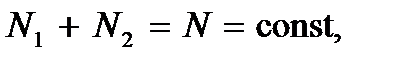 то
то 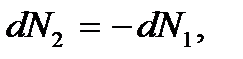 и тогда
и тогда 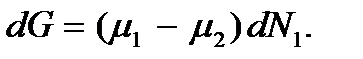 Поскольку система не находится в равновесии, то ее термодинамический потенциал будет уменьшаться:
Поскольку система не находится в равновесии, то ее термодинамический потенциал будет уменьшаться: 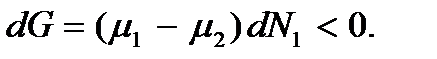 Отсюда следует, что если
Отсюда следует, что если 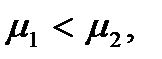 то
то 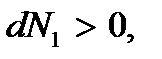 а
а 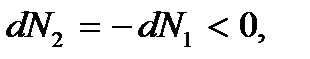 т.е. число частиц в первой фазе возрастает, а во второй уменьшается. Это означает, что переход вещества происходит из второй фазы в первую, т.е. имеет место процесс конденсации. Процесс будет продолжаться до тех пор пока все вещество не окажется в фазе 1, т.е. пока пар полностью не сконденсируется. В этом случае термодинамический потенциал достигнет минимального значения
т.е. число частиц в первой фазе возрастает, а во второй уменьшается. Это означает, что переход вещества происходит из второй фазы в первую, т.е. имеет место процесс конденсации. Процесс будет продолжаться до тех пор пока все вещество не окажется в фазе 1, т.е. пока пар полностью не сконденсируется. В этом случае термодинамический потенциал достигнет минимального значения 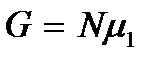 . Отсюда следует, что при
. Отсюда следует, что при 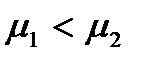 термодинамически устойчивой будет фаза 1 (жидкость), так как небольшое уменьшение числа частиц в первой фазе и увеличение их во второй вызовет поток частиц из второй фазы в первую. Если имеет место неравенство
термодинамически устойчивой будет фаза 1 (жидкость), так как небольшое уменьшение числа частиц в первой фазе и увеличение их во второй вызовет поток частиц из второй фазы в первую. Если имеет место неравенство 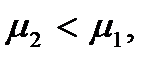 то
то 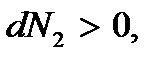 а
а 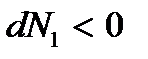 . Переход вещества будет происходить из фазы 1 в фазу 2 – парообразование. Термодинамический потенциал достигнет своего минимального значения
. Переход вещества будет происходить из фазы 1 в фазу 2 – парообразование. Термодинамический потенциал достигнет своего минимального значения 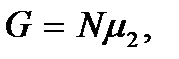 когда все вещество перейдет в парообразное состояние; термодинамически устойчивой будет фаза 2 (пар).
когда все вещество перейдет в парообразное состояние; термодинамически устойчивой будет фаза 2 (пар).
|
|
|
Поскольку химический потенциал, как и термодинамический потенциал Гиббса, является функцией температуры Т и давления р, то выполнение того или иного неравенства потенциалов фаз определяется значениями температуры и давления: при одних значениях Т и р меньшим окажется химический потенциал жидкости, а при других – пара. Это означает, что при одних значениях температуры и давления устойчивой будет жидкая фаза, а при других – газообразная. Если температура и давление таковы, что 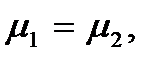 то выполняется условие минимума термодинамического потенциала
то выполняется условие минимума термодинамического потенциала 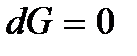 – двухфазная система (жидкость + пар) будет находиться в равновесии. В этом случае
– двухфазная система (жидкость + пар) будет находиться в равновесии. В этом случае 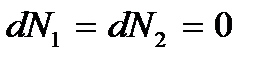 – переход вещества из одной фазы в другую не происходит. Имеет место равновесие фаз между собой. Таким образом, условием равновесия двух фаз является равенство их химических потенциалов:
– переход вещества из одной фазы в другую не происходит. Имеет место равновесие фаз между собой. Таким образом, условием равновесия двух фаз является равенство их химических потенциалов:
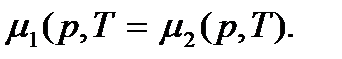 (7.5)
(7.5)
При этом температуры и давления фаз также равны друг другу:
|
|
|
Т 1 = Т 2 = Т, р 1 = р 2 = р,
где. Т и р – температура и давление фазового равновесия и перехода.
Учитывая определение химического потенциала, перепишем равенство (7.5) в виде
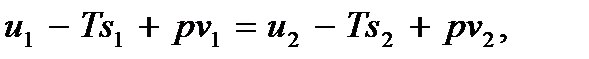
где u, s, v – удельная (в расчете на одну молекулу) внутренняя энергия, энтропия и объем фаз соответственно. Откуда
u 2 – u 1 + p (v 2 – v 1) = T (s 2 – s 1)
или
∆ u + p ∆ v = T ∆ s.
Согласно первому закону термодинамики, левая часть этого равенства есть удельная теплота фазового перехода q. Следовательно,
q = T (s 2 – s 1).
Отсюда видно, что если энтропия конечной фазы больше энтропии начальной фазы, т.е. s 2 > s 1, то q > 0 – фазовый переход (парообразование) происходит с поглощением теплоты; если же, наоборот, s 2 < s 1, то q < 0 – фазовый переход (конденсация) происходит с выделением теплоты. Превращения вещества из одной фазы в другую, связанные с поглощением или выделением теплоты, называются фазовыми переходами первого рода. Существуют фазовые переходы и второго рода, которые не сопровождаются поглощением или выделением тепла.
 2015-09-06
2015-09-06 586
586








