Обратимся снова к равенству (7.5) и подчеркнем еще раз, что оно имеет место только при определенной температуре и давлении (температуре и давлении фазового перехода). При температурах выше или ниже заданного значения это равенство нарушается. В этом случае будет стабильной либо первая, либо вторая фаза (при 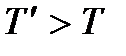 – газообразная, а при
– газообразная, а при 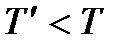 – жидкая). Как видим, причиной фазовых превращений является изменение стабильности фаз в зависимости от изменения внешних условий (температуры и давления).
– жидкая). Как видим, причиной фазовых превращений является изменение стабильности фаз в зависимости от изменения внешних условий (температуры и давления).
Зная выражения функциональных зависимостей μ (p, T) и ре-
шая уравнение (7.5), можно выразить один из аргументов химиче
ского потенциала через другой, т.е. найти зависимость р = р (Т). Отсюда следует, что две фазы одного и того же вещества могут находиться в равновесии друг с другом не при любом давлении и температуре, эти величины связаны между собой функциональной зависимостью. На плоскости рТ эта зависимость изображается в виде кривой (сплошная кривая на рис. 7.7), называемой кривой равновесия фаз или кривой фазового перехода. В любой точке, лежащей на этой кривой, фазы равновесно сосуществуют друг с другом. На этой кривой μ 1 = μ 2, выше и левее кривой μ 2 < μ 1, а ниже и правее μ 1 < μ 2. Следовательно, кривая фазового равнове-
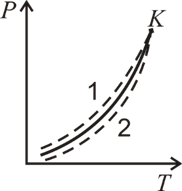 Рис. 7.7 Рис. 7.7 |
сия разбивает плоскость рТ на две области: в первой из них, где μ 1 < μ 2 стабильной является только фаза 1 (жидкость), во второй области, где μ 2 < μ 1 термодинамически устойчивой является только фаза 2 (газ). Плоскость, разделенная на две части кривой сосуществования фаз, называется фазовой диаграммой или диаграммой состояний. Сама кривая р = р (Т) является, таким образом, границей устойчивости фаз. При изменении состояния вещества вдоль любой линии, пересекающей кривую равновесия, в точке пересечения произойдет расслоение, после чего вещество скачком переходит в другую фазу. Кривая фазового равновесия жидкость – пар оканчивается в критической точке К. К кривой
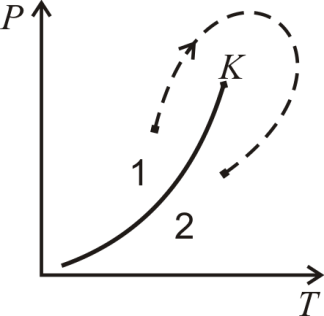 Рис. 7.8 Рис. 7.8 |
равновесия двух фаз вещества примыкают области существования метастабильных состояний (пунктирные линии на рис. 7.7). Это значит, что в области 1, в которой строго термодинамически устойчивой является жидкое состояние, может при некоторых условиях существовать в полуустойчивом, метастабильном состоянии пар – пересыщенный пар. Наоборот, в области 2, в которой устойчивым является газообразное состояние, может при некоторых условиях существовать в метастабильном состоянии жидкость – перегретая жидкость. С ростом кривой p (T) полосы, примыкающие к кривой равновесия, сужаются, стягиваясь в точку в критической точке К.
При наличии критической точки между всякими двумя состояниями может быть произведен непрерывный переход, при котором ни в какой момент не происходит расслоения на две фазы. Для этого надо менять состояние вдоль какой-либо кривой, огибающей критическую точку слева (или справа) и нигде не пересекающей кривую равновесия (один из таких процессов изображен на рис. 7.8 пунктирной стрелкой). Пунктирной стрелкой показан процесс непрерывного перехода между указанными состояниями и на диаграмме в плоскости VT (рис. 7.9). Область 1 + 2 на этом рисунке соответствует равновесному сосуществованию двух фаз 1 и 2.
Получим теперь дифференциальное уравнение, описываю-
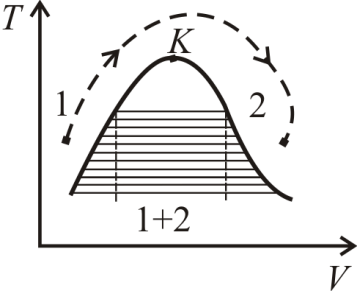 Рис. 7.9 Рис. 7.9 |
щее кривую фазового равновесия. Представим себе, что с некоторым количеством вещества (например, с одним молем) производится очень «узкий» цикл Карно, в котором изотермическими процессами являются переход этого вещества из фазы 2 в фазу 1 при температуре T и при давлении р и обратный переход из фазы 1 в фазу 2 при температуре T + dT и давлении p + dp. Эти переходы изображаются на фазовой диаграмме pV -плоскости (рис. 7.10) отрезками ab и cd. Что касается «боковых» сторон bc и da, то вместо них следовало бы взять отрезки адиабат; однако в пределе бесконечно узкого цикла это различие несущественно – оно не сказывается на площади цикла (т.е. на произведенной в этом цикле работе), равной, очевидно,
δА = dp (V 2 – V 1
где V 1 и V 2 – молярные объемы соответственно первой и второй фаз. На совершение этой работы теплота затрачивается только на участке cd, на котором молярный объем V вещества возрастает от V 1 до V 2. Если молярная теплота фазового перехода 1 → 2 равна 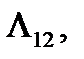 то для КПД цикла будем иметь
то для КПД цикла будем иметь
η = δА / 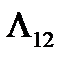 = dp (V 2 – V 1) /
= dp (V 2 – V 1) / 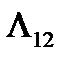 .
.
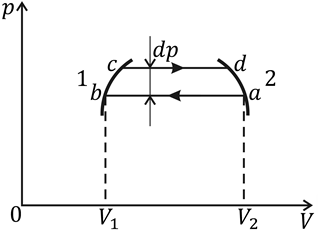 Рис. 7.10 Рис. 7.10 |
С другой стороны, тот же КПД как КПД цикла Карно с температурами нагревателя T + dT и охладителя Т равен
[ T + dT – T ] / (T + dT) 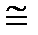
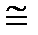 dT / T.
dT / T.
Приравнивая оба выражения для КПД, получим
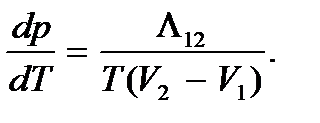 (7.6)
(7.6)
Это уравнение называется уравнением Клапейрона – Клаузиуса. Оно справедливо для любого фазового перехода первого рода и определяет изменение давления при изменении температуры вдоль кривой равновесия фаз, т.е. наклон кривой фазового равновесия p = p (T). То же уравнение, записанное в виде
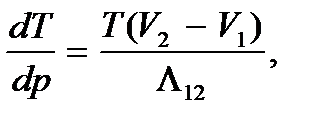 (7.7)
(7.7)
определяет изменение температуры фазового перехода при изменении давления. Согласно (7.7) знак производной 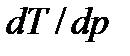 зависит от того, возрастает ли объем при фазовом переходе, сопровождающемся поглощением тепла, или же он уменьшается. Так, переход вещества из низкотемпературной фазы в фазу высокотемпературную (испарение) сопровождается увеличением объема. Для таких переходов
зависит от того, возрастает ли объем при фазовом переходе, сопровождающемся поглощением тепла, или же он уменьшается. Так, переход вещества из низкотемпературной фазы в фазу высокотемпературную (испарение) сопровождается увеличением объема. Для таких переходов 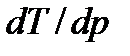 > 0, т.е. с повышением давления температура фазового перехода будет повышаться.
> 0, т.е. с повышением давления температура фазового перехода будет повышаться.
Направление кривой фазового перехода в плоскости рТ с изменением объема можно связать и с помощью принципа Ле-Шателье. Пусть, например, равновесная система из жидкости и пара подвергается сжатию, так что давление в ней повышается. Тогда в системе должны произойти процессы, уменьшающие объем вещества и тем самым ослабляющие влияние сжатия. Для этого должна произойти конденсация пара, поскольку переход пара в жидкость всегда сопровождается уменьшением объема. Это значит, что при смещении вверх от кривой равновесия мы должны попасть в область жидкой фазы. С другой стороны, жидкость является низкотемпературной фазой. Учитывая это, мы приходим к выводу, что кривая равновесия жидкости и пара должна быть расположена так, как показано на рис. 7.8: температура перехода должна возрастать с увеличением давления.
 2015-09-06
2015-09-06 1871
1871
