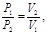 Закон Бойля–Мариотта: при постоянной температурe, давление, производимое данной массой газа, обратно пропорционально объему газа
Закон Бойля–Мариотта: при постоянной температурe, давление, производимое данной массой газа, обратно пропорционально объему газа
Закон Гей-Люссака: при постоянном давлении объем газа изменяется прямо пропорционально абсолютной температуре
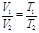 |
Закон Шарля: при постоянном объеме давление газа изменяется прямо пропорционально абсолютной температуре.
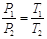 |
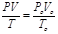 Объединенный закон Бойля-Мариотта, Гей-Люссака и Шарля:
Объединенный закон Бойля-Мариотта, Гей-Люссака и Шарля:
Уравнение Клапейрона-Менделеева:
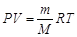 |
Закон парциальных давлений Дальтона:
Общее давление газовой смеси равно сумме парциальных давлений газов, составляющих эту смесь: n
Р(общ)=Σ(Рi)
i=1
6. Закон Авогадро: (Авогадро, 1811г.) – в равных объемах различных газов при одинаковых условиях (температуры и давлении) содержится одинаковое число молекул.
5. Модели строения атома по Резерфорду и Бору Модель Резерфорда1. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома.2. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре (масса электрона равна 1/1823 а.е.м.).3. Вокруг ядра вращаются электроны. Их число равно положительному заряду ядра.
Атом может находиться только в особенных стационарных, или квантовых, состояниях, каждому из которых отвечает определенная энергия. В стационарном состоянии атом не излучает электромагнитных волн. 2.Излучение и поглощение энергии атомом происходит при скачкообразном переходе из одного стационарного состояния в другое
 2015-09-06
2015-09-06 2193
2193








