Під системою взагалі розуміємо безліч елементів, що перебувають у певних відносинах і зв’язках один з одним, і утворюють певну цілісність, єдність. Очевидно, що під системою тіл варто розуміти сукупність взаємодіючих тіл, для яких розглядаються деякі загальні властивості. Одне макроскопічне тіло теж можна назвати системою, маючи на увазі те, що воно складається з безлічі взаємодіючих між собою атомів або молекул. Тіла, що не входять в обрану таким способом систему, але здатні впливати на неї, називають зовнішнім середовищем або просто середовищем. Систему тіл, що не можуть обмінюватися енергією і речовиною з навколишнім середовищем, називають ізольованою чи замкненою системою. Така система насправді точно ніколи не реалізується, отже, поняття замкненої системи є ідеалізацією.
Сукупність фізичних тіл, що можуть взаємодіяти між собою та з зовнішнім середовищем, обмінюючись енергією і речовиною, називають термодинамічною системою. Термодинамічна система складається з досить великої кількості структурних частинок (атомів, молекул тощо), і її стан можна характеризувати макроскопічними параметрами. Параметр – це фізична величина, що характеризує певну властивість процесу, явища, системи (наприклад, об’єм, який займає газ, температура тіла, кінетична енергія тіла, напруженість електричного поля та ін.). Параметр може бути виміряний чи розрахований за певними рівняннями.
Під процесом розуміємо послідовну зміну станів стадій розвитку.
 Кожна система в будь-який момент часу перебуває в якомусь стані. Стан системи, описаний за допомогою макроскопічних параметрів, називається макроскопічним станом або макростаном. Саме в цьому розумінні поняття стану вживається в термодинаміці.
Кожна система в будь-який момент часу перебуває в якомусь стані. Стан системи, описаний за допомогою макроскопічних параметрів, називається макроскопічним станом або макростаном. Саме в цьому розумінні поняття стану вживається в термодинаміці.
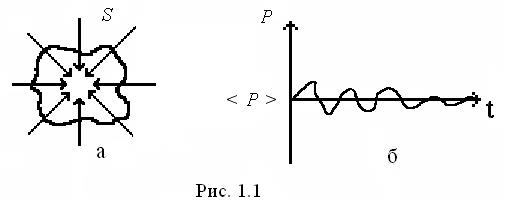
Фізичну суть макроскопічних параметрів з мікроскопічної (молекулярної) точки зору можна розглянути на прикладі тиску газу на стінки посудини. Як вже зазначалося вище, цей тиск є результатом ударів об стінку молекул (чи атомів), що хаотично рухаються в об’ємі посудини. Розглянемо малу ділянку стінки посудини з площею 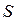 (рис. 1.1а). Позначимо через
(рис. 1.1а). Позначимо через 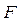 сумарну силу, з якою у кожний момент часу діють на розглянуту ділянку молекули, стикаючись зі стінкою. Сила, віднесена до одиниці площі, дає тиск
сумарну силу, з якою у кожний момент часу діють на розглянуту ділянку молекули, стикаючись зі стінкою. Сила, віднесена до одиниці площі, дає тиск 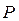 газу на стінку посудини:
газу на стінку посудини: 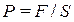 . Ця величина не залишається строго постійною в часі. Вона коливається біля деякого середнього значення
. Ця величина не залишається строго постійною в часі. Вона коливається біля деякого середнього значення 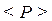 (рис. 1.1б). У термодинаміці розглядається не миттєве значення
(рис. 1.1б). У термодинаміці розглядається не миттєве значення 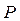 , а середнє
, а середнє 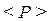 за великий проміжок часу – дуже великий у порівнянні з тривалістю одного удару чи з тривалістю проміжку часу між двома ударами молекул. Цю середню величину
за великий проміжок часу – дуже великий у порівнянні з тривалістю одного удару чи з тривалістю проміжку часу між двома ударами молекул. Цю середню величину 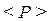 при макроскопічному розгляді і приймають за тиск газу. Та обставина, що макроскопічними вимірювальними приладами тиск газу сприймається як сила, безперервна в часі і рівномірно розподілена по всій площі, на яку вона діє, пояснюється дуже великою кількістю молекул газу, що бомбардують цю площу, а також надзвичайно малими їх розмірами.
при макроскопічному розгляді і приймають за тиск газу. Та обставина, що макроскопічними вимірювальними приладами тиск газу сприймається як сила, безперервна в часі і рівномірно розподілена по всій площі, на яку вона діє, пояснюється дуже великою кількістю молекул газу, що бомбардують цю площу, а також надзвичайно малими їх розмірами.
З цього прикладу видно, що макроскопічні параметри мають зміст середніх значень (за великий проміжок часу) деяких функцій системи, які характеризують її стан.
Макроскопічні параметри системи підрозділяють на внутрішні та зовнішні. Внутрішні параметри визначають внутрішній стан системи. Зовнішні параметри визначаються зовнішніми тілами і силовими полями, що діють на систему. Розглянемо деякі приклади.
Нехай газ міститься у посудині з нерухомими стінками. Об’єм, який займає газ у даному випадку, є зовнішнім параметром, оскільки він визначається розташуванням зовнішніх тіл – стінок посудини. Тиск газу на стінки посудини залежить від швидкостей теплового руху молекул. У даному випадку він є внутрішнім параметром.
Припустимо тепер, що той самий газ міститься у вертикальному циліндрі під поршнем, який може вільно переміщатися; якщо площа поршня дорівнює 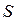 , а сила ваги поршня дорівнює
, а сила ваги поршня дорівнює 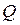 , то, відповідно до третього закону Ньютона, газ діє на поршень з тією самою за величиною силою
, то, відповідно до третього закону Ньютона, газ діє на поршень з тією самою за величиною силою 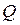 , а тиск газу на поршень і стінки циліндра
, а тиск газу на поршень і стінки циліндра 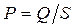 визначається вагою поршня
визначається вагою поршня 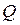 і є зовнішнім параметром. Однак тепер об’єм газу в циліндрі під поршнем стає внутрішнім параметром, оскільки положення поршня визначається внутрішніми властивостями газу.
і є зовнішнім параметром. Однак тепер об’єм газу в циліндрі під поршнем стає внутрішнім параметром, оскільки положення поршня визначається внутрішніми властивостями газу.
Якщо параметри системи тривалий час не змінюються та у системі немає яких-небудь стаціонарних потоків (теплоти, речовини тощо), то кажуть, що система перебуває у стані термодинамічної рівноваги. Досвід підтверджує, що будь-яка нерівноважна термодинамічна система, будучи надана сама собі, спонтанно перейде в рівноважний стан. Спонтанний процес переходу системи в стан термодинамічної рівноваги називають релаксацією, а час, витрачений на такий перехід – часом релаксації. Процеси, що складаються з безупинно змінюючих один одного станів рівноваги, називають квазістатичними чи квазірівноважними. Найчастіше їх називають просто рівноважними. Ясно, що такі процеси повинні протікати нескінченно повільно і що вони у природі не існують. Однак деякі процеси протікають подібно рівноважним. Введення поняття рівноважних процесів суттєво спрощує термодинамічний розгляд реальних явищ.
Для рівноважних термодинамічних систем вводиться поняття температури як макроскопічного параметра стану, що має однакове значення для всіх макроскопічних частин системи.
Узагальнення численних експериментальних даних дає змогу зробити висновок про те, що в стані термодинамічної рівноваги кожний внутрішній параметр системи є однозначною функцією зовнішніх параметрів і температури системи.
 2015-09-06
2015-09-06 6098
6098
