Найпростішим об'єктом досліджень в молекулярній фізиці і термодинаміці є ідеальний газ. Багато газів (водень, гелій, кисень, повітря тощо) за звичайних температур та атмосферних тисків з деяким наближенням можна вважати ідеальними. Так, за звичайних умов концентрація газів становить приблизно 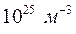 . За такої концентрації середня відстань між молекулами (
. За такої концентрації середня відстань між молекулами (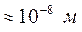 ) настільки велика в порівнянні з їх розмірами (
) настільки велика в порівнянні з їх розмірами (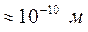 ), що силами взаємодії між молекулами можна знехтувати. Сумарний власний об’єм молекул в об’ємі
), що силами взаємодії між молекулами можна знехтувати. Сумарний власний об’єм молекул в об’ємі 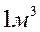 приблизно дорівнює
приблизно дорівнює 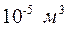 , і його за певного наближення теж можна не враховувати.
, і його за певного наближення теж можна не враховувати.
На основі експериментів з такими досить розрідженими газами було виявлено ряд законів, які строго виконуються для ідеальних газів, а для реальних газів можуть бути використані лише за певних умов: не дуже низька температура, відносно низький тиск, проста структура, малий розмір і низька концентрація молекул газу та ін.
 Закон Бойля–Маріотта. У 1662р. англійський вчений Р.Бойль, вимірюючи об'єм газу за різного тиску, виявив, що за постійної температури об'єм
Закон Бойля–Маріотта. У 1662р. англійський вчений Р.Бойль, вимірюючи об'єм газу за різного тиску, виявив, що за постійної температури об'єм 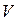 даної маси газу обернено пропорційний до його тиску, тобто
даної маси газу обернено пропорційний до його тиску, тобто
(1.1)
де 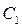 – постійна величина, пропорційна кількості молів газу і його абсолютній температурі. Незалежно від Р. Бойля французький вчений Е. Маріотт у 1676р. дійшов такого ж висновку. Це відкриття і отримало назву закону Бойля–Маріотта.
– постійна величина, пропорційна кількості молів газу і його абсолютній температурі. Незалежно від Р. Бойля французький вчений Е. Маріотт у 1676р. дійшов такого ж висновку. Це відкриття і отримало назву закону Бойля–Маріотта.
Закон Гей-Люссака. У 1802 р. французький учений Ж.Л. Гей-Люссак опублікував виявлений ним закон, згідно з яким об’єм даної маси газу за постійного тиску змінюється лінійно з температурою, тобто:
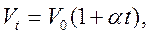 (1.2)
(1.2)
де 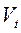 і
і 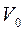 – об’єми газу відповідно при температурах t ° С і 0°С;
– об’єми газу відповідно при температурах t ° С і 0°С; 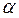 –термічний коефіцієнт розширення при постійному тиску. Величина
–термічний коефіцієнт розширення при постійному тиску. Величина 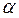 для всіх газів за нормальних умов приблизно однакова і дорівнює 1/273 К-1 у разі вимірювання температури газу в градусах Кельвіна.
для всіх газів за нормальних умов приблизно однакова і дорівнює 1/273 К-1 у разі вимірювання температури газу в градусах Кельвіна.
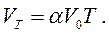 Переходячи до абсолютної шкали температур, рівняння закону Гей-Люссака можна записати у вигляді:
Переходячи до абсолютної шкали температур, рівняння закону Гей-Люссака можна записати у вигляді:
(1.3)
Закон Шарля. У 1787 р. французький фізик Ж.Шарль виявив закон,
відповідно до якого тиск даної маси газу при постійному об’ємі змінюється лінійно з температурою, тобто:
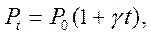 (1.4)
(1.4)
де 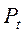 і
і 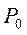 – тиск газу відповідно за температур t °С і 0°С;
– тиск газу відповідно за температур t °С і 0°С; 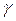 – термічний коефіцієнт тиску за постійного об’єму. Величина
– термічний коефіцієнт тиску за постійного об’єму. Величина 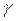 для всіх газів за нормальних умов приблизно однакова і, аналогічно величині
для всіх газів за нормальних умов приблизно однакова і, аналогічно величині 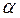 , дорівнює
, дорівнює
1/273 К-1.
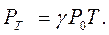 Переходячи до абсолютної шкали температур, закон Шарля запишемо у вигляді рівняння:
Переходячи до абсолютної шкали температур, закон Шарля запишемо у вигляді рівняння:
(1.5)
Закон Авогадро. У 1805 р. Гей-Люссак сформулював закон з’єднувальних об'ємів для газів, відповідно до якого об'єми газів, що реагують між собою чи утворюються при хімічній реакції, знаходяться у відношеннях невеликих цілих чисел. Для пояснення цього емпіричного закону італійський вчений А.Авогадро в 1811р. висунув гіпотезу, відповідно до якої в рівних об'ємах різних газів за однакових температур і тисків міститься однакове число молекул. Ця гіпотеза була підтверджена дослідно з точністю, що відповідає відхиленню реального газу від ідеального, і в даний час вважається законом Авогадро.
А із закону Авогадро випливає, що один моль будь-якого газу, близького за станом до ідеального, за однакових температур і тисків займає один і той же об'єм.
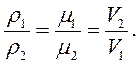 За нормальних умов цей об'єм
За нормальних умов цей об'єм 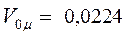 м3/моль
м3/моль 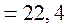 л/моль. Це призводить до такого співвідношення між густинами
л/моль. Це призводить до такого співвідношення між густинами 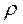 , молярними масами
, молярними масами 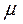 і питомими об'ємами
і питомими об'ємами 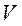 двох газів:
двох газів:
(1.6)
Питомий об'єм – це об'єм одиниці маси речовини. Молярна маса – це маса одного моля речовини. Під молем розуміємо кількість речовини, що містить стільки ж структурних одиниць (молекул, атомів чи інших частинок), скільки атомів міститься в ізотопі вуглецю 12Смасою 0,012 кг. Це число атомів називають числом Авогадро 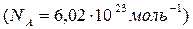 .
.
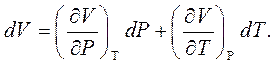 Рівняння стану ідеального газу. Оскільки відповідно до законів Бойля-Маріотта і Гей-Люссака об'єм даної маси газу є функцією тиску і температури:
Рівняння стану ідеального газу. Оскільки відповідно до законів Бойля-Маріотта і Гей-Люссака об'єм даної маси газу є функцією тиску і температури: 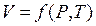 ,то його повний диференціал:
,то його повний диференціал:
(1.7)
Оскільки 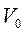 не є функцією температури, то рівняння (1.3) можна записати у вигляді:
не є функцією температури, то рівняння (1.3) можна записати у вигляді: 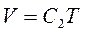 . Тоді з рівнянь (1.1) і (1.3) знаходимо:
. Тоді з рівнянь (1.1) і (1.3) знаходимо:
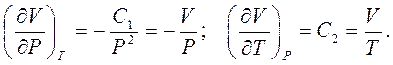 |
(1.8)
Підставивши значення системи рівнянь (1.8) у рівняння (1.7), одержимо:
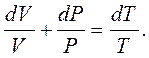
(1.9)
Інтегруючи рівняння (1.9), одержуємо:
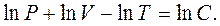 (1.10)
(1.10)
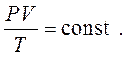 де С – постійна інтегрування. Потенціюючи це рівняння, одержуємо рівняння стану ідеального газу:
де С – постійна інтегрування. Потенціюючи це рівняння, одержуємо рівняння стану ідеального газу:
(1.11)
Це рівняння було отримано в 1834 р. французьким фізиком Б.Клапейроном. У 1874 р. Д.І.Менделєєв надав рівнянню (1.11) більш універсального вигляду, записавши його для одного моля газу з об’ємом 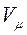 :
:
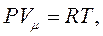 (1.12)
(1.12)
де R – постійна величина, що відповідно до закону Авогадро буде
однаковою для всіх газів, якщо кількість газу дорівнює одному молю. Тому її
називають універсальної газовою сталою. Чисельно їїзначення, що дорівнює
8,31 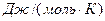 , можна розрахувати за рівнянням (1.11) за нормальних умов
, можна розрахувати за рівнянням (1.11) за нормальних умов 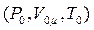 .
.
Помноживши рівняння (1.12) на число молів 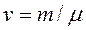 , одержимо рівняння стану ідеального газу для довільної маси
, одержимо рівняння стану ідеального газу для довільної маси 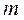 :
:
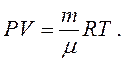
(1.13)
Рівняння (1.12) і (1.13) називають рівняннями Менделєєва-Клапейрона.
Вони поєднують усі газові закони: Бойля-Маріотта, Гей-Люссака, Шарля, Авогадро.
 2015-09-06
2015-09-06 3674
3674








