Відношення теплоти 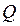 , отриманої тілом в ізотермічному процесі, до температури
, отриманої тілом в ізотермічному процесі, до температури 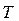 „джерела теплоти” німецький Фізик Р. Клаузіус назвав зведеною кількістю теплоти
„джерела теплоти” німецький Фізик Р. Клаузіус назвав зведеною кількістю теплоти 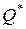 :
:
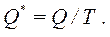 (3.8)
(3.8)
При нагріванні тіла 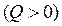 зведена теплота
зведена теплота 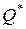 позитивна, при охолодженні – негативна. Зведена кількість теплоти, надана тілу на кожній нескінченно малій ділянці процесу, дорівнює
позитивна, при охолодженні – негативна. Зведена кількість теплоти, надана тілу на кожній нескінченно малій ділянці процесу, дорівнює 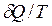 . Сумуючи ці величини для всіх ділянок довільного ізотермічного процесу 1-2, одержимо таке вираження зведеної кількості теплоти:
. Сумуючи ці величини для всіх ділянок довільного ізотермічного процесу 1-2, одержимо таке вираження зведеної кількості теплоти:
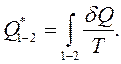 .
.
Підрахуємо зведену кількість теплоти 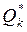 , надану тілу в прямому оборотному циклі Карно (рис. 3.2):
, надану тілу в прямому оборотному циклі Карно (рис. 3.2):
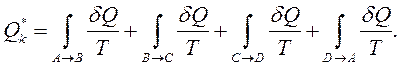 |
В адіабатних процесах 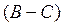 і
і 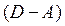
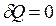 .Тому:
.Тому:
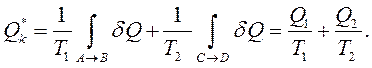
Відповідно до рівняння (3.7) для оборотного циклу Карно одержуємо:
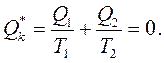 |
(3.10)
Виявилося, що цей результат справедливий для будь-якого оборотного циклу. Його можна сформулювати в такий спосіб: „Зведена кількість теплоти, надана тілу в будь-якому оборотному коловому процесі, дорівнює нулю”:
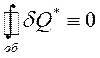 . (3.11)
. (3.11)
З тотожності (3.11) випливає, що підінтегральний вираз 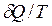 , на відміну від
, на відміну від 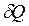 , є повним диференціалом деякої функції
, є повним диференціалом деякої функції 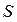 :
:
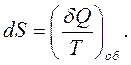 |
(3.12)
Введену в такий спосіб у 1865 році Р. Клаузіусом функцію 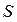 називають ентропією. Подібно до внутрішньої енергії
називають ентропією. Подібно до внутрішньої енергії 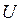 , ентропія
, ентропія 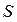 є однозначною функцією стану системи. З рівняння (3.12) випливає, що
є однозначною функцією стану системи. З рівняння (3.12) випливає, що 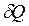 та
та 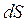 мають один і той самий знак. Отже, за характером зміни ентропії системи можна судити про напрямок процесу теплообміну (при нагріванні тіла його ентропія зростає, при охолодженні – зменшується).
мають один і той самий знак. Отже, за характером зміни ентропії системи можна судити про напрямок процесу теплообміну (при нагріванні тіла його ентропія зростає, при охолодженні – зменшується).
Як приклад розглянемо ентропію ідеального газу, для якого за першим законом термодинаміки з урахуванням рівняння (2.24) маємо:
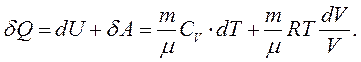 |
Звідси знаходимо:
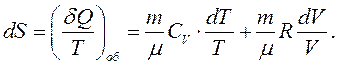 |
(3.13)
Під час переходу ідеального газу зі стану 1 у стан 2 зміна його ентропії дорівнює:
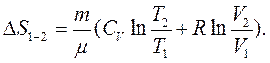 |
(3.14)
З рівняння (3.14) випливає, що зміна ентропії ідеального газу не залежить від виду процесу, що є характерним для функції стану системи.
Ентропія системи тіл дорівнює сумі ентропії всіх тіл, що входять у систему. Розглянемо замкнену систему, що складається з нагрівача, холодильника, робочого тіла й споживача роботи. Зміна ентропії цієї системи під час здійснення робочим тілом циклу Карно дорівнює:
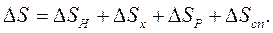 |
Робоче тіло в результаті здійснення циклу Карно повертається у вихідний стан, тож зміна його ентропії 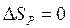 . Споживач роботи одержує енергію тільки у формі роботи, і зміна його ентропії
. Споживач роботи одержує енергію тільки у формі роботи, і зміна його ентропії 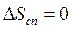 . Зміна ентропії нагрівача й холодильника в ізотермічних процесах дорівнює:
. Зміна ентропії нагрівача й холодильника в ізотермічних процесах дорівнює:
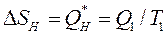 | 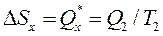 |
;
Зміна ентропії розглянутої системи дорівнює:
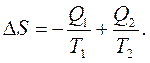 |
(3.15)
Відповідно до нерівності Клаузіуса, у якій 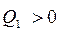 , а
, а 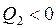 , знаходимо:
, знаходимо:
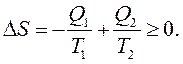 |
(3.16)
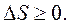 В термодинаміці доведено, що отриманий висновок можна узагальнити на довільний процес, що відбувається в замкненій системі:
В термодинаміці доведено, що отриманий висновок можна узагальнити на довільний процес, що відбувається в замкненій системі:
(3.17)
Словесне формулювання цього твердження може бути таким: „Ентропія замкненої системи за будь-яких протікаючих у ній процесів не може зменшуватись. У випадку оборотних процесів вона залишається незмінною 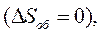 у випадку необоротних – зростає
у випадку необоротних – зростає 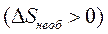 ”.
”.
З визначення ентропії 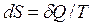 випливає, що для оборотних процесів
випливає, що для оборотних процесів 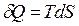 , для необоротних:
, для необоротних:
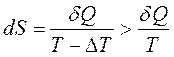
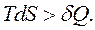 і
і
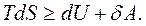 З урахуванням цього рівняння першого закону термодинаміки можна записати у вигляді:
З урахуванням цього рівняння першого закону термодинаміки можна записати у вигляді:
(3.18)
 2015-09-06
2015-09-06 1243
1243








