Закони, які описують ідеальні гази, не можуть бути перенесені на реальні гази. Для реальних газів ними можна користуватись лише тоді, коли газ перебуває при низьких тисках і високих температурах, тобто за таких умов, коли можна без помітної шкоди нехтувати власними розмірами молекул газу і силами взаємодії між ними. Саме це є основною умовою ідеалізації газу.
Поведінка ідеальних газів досить добре описується рівнянням Мендєлєєва-Клапейрона
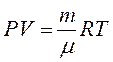 (8.1)
(8.1)
 лише при не дуже високих тисках і достатньо високих температурах. З підвищенням тиску і зниженням температури спостерігаються відхилення від цього рівняння. Так, при температурі
лише при не дуже високих тисках і достатньо високих температурах. З підвищенням тиску і зниженням температури спостерігаються відхилення від цього рівняння. Так, при температурі 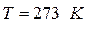 і тиску
і тиску 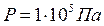 добуток тиску на об’єм
добуток тиску на об’єм 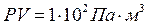 , а при тій самій температурі і тиску
, а при тій самій температурі і тиску 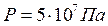 добуток
добуток 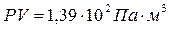 , тобто при
, тобто при 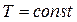
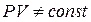 . Це зумовлено тим, що при виведенні рівняння (8.1) не врахований власний об’єм молекул і їх взаємодія між собою. Приймаючи радіус молекули
. Це зумовлено тим, що при виведенні рівняння (8.1) не врахований власний об’єм молекул і їх взаємодія між собою. Приймаючи радіус молекули 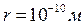 , знаходимо, що об’єм однієї молекули
, знаходимо, що об’єм однієї молекули 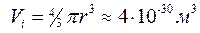 . Отже, за нормальних умов (
. Отже, за нормальних умов (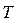 = 273
= 273 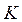
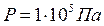 ) в одному кубічному метрі міститься
) в одному кубічному метрі міститься 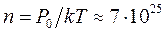 молекул, а їх власний об’єм
молекул, а їх власний об’єм 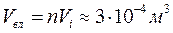 . Цим об’ємом можна знехтувати в порівнянні з об’ємом газу, що дорівнює 1м3. Якби рівняння (8.1) виконувалося для реальних газів завжди, то при підвищенні тиску до
. Цим об’ємом можна знехтувати в порівнянні з об’ємом газу, що дорівнює 1м3. Якби рівняння (8.1) виконувалося для реальних газів завжди, то при підвищенні тиску до 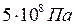 , його густина збільшилася б у 5000 разів, а власний об’єм молекул у 1м3 був би 0,5 м3, тобто займав би половину всього об’єму. Доступний для руху молекул об’єм замінився б об’ємом вдвічі меншим. Очевидно, що за таких умов зворотна пропорційність між об’ємом та тиском повинна порушуватись.
, його густина збільшилася б у 5000 разів, а власний об’єм молекул у 1м3 був би 0,5 м3, тобто займав би половину всього об’єму. Доступний для руху молекул об’єм замінився б об’ємом вдвічі меншим. Очевидно, що за таких умов зворотна пропорційність між об’ємом та тиском повинна порушуватись.
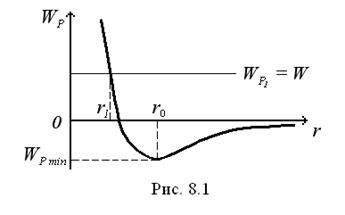
Якщо прийняти, що потенці-альна енергія взаємодії між мо-лекулами дорівнює нулю, коли відстань між ними прагне до не-скінченності (а це випливає із закону тяжіння), то характер взаємодії між молекулами має такий графічний вигляд, як на (рис. 8.1).
Оскільки сили взаємодії між молекулами мають електростатичну природу, то сумарну силу знаходимо із співвідношення між силою 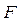 та потенціальною енергією
та потенціальною енергією 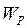 :
:
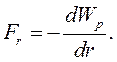 (8.2)
(8.2)
Очевидно, що при 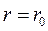 сила
сила 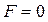 , а потенціальна енергія мінімальна. Такий стан газу називають рівноважним. Знак “–” в рівнянні (8.2) вказує на те, що сили взаємодії прагнуть перевести систему в стан з мінімальною потенціальною енергією, що відповідає відстані між молекулами
, а потенціальна енергія мінімальна. Такий стан газу називають рівноважним. Знак “–” в рівнянні (8.2) вказує на те, що сили взаємодії прагнуть перевести систему в стан з мінімальною потенціальною енергією, що відповідає відстані між молекулами 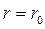 . Отже при
. Отже при 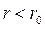 між молекулами діють сили відштовхування, а при
між молекулами діють сили відштовхування, а при 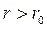 – сили притягання. Взаємодія між молекулами впливає на поведінку газу в цілому, що особливо проявляється при підвищених тисках.
– сили притягання. Взаємодія між молекулами впливає на поведінку газу в цілому, що особливо проявляється при підвищених тисках.
Для системи, що складається з двох молекул, сили взаємодії є внутрішніми, тобто така система є замкненою. Повна енергія такої системи складається з кінетичної 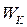 та потенціальної
та потенціальної 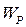 :
:
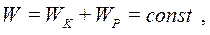 (8.3)
(8.3)
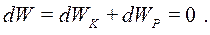 |
тобто (8.4)
На підставі рівнянь (8.2) та (8.4) отримаємо:
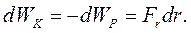 (8.5)
(8.5)
При зближенні молекул (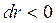 ) до відстані
) до відстані 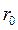 їх взаємна потенціальна енергія зменшується, а кінетична відповідно збільшується. Це відбувається за рахунок позитивної роботи сумарної сили взаємного притягання між молекулами, (
їх взаємна потенціальна енергія зменшується, а кінетична відповідно збільшується. Це відбувається за рахунок позитивної роботи сумарної сили взаємного притягання між молекулами, (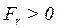 при
при 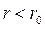 ). Отже, цей процес пов’язаний зі зменшенням кінетичної енергії молекул.
). Отже, цей процес пов’язаний зі зменшенням кінетичної енергії молекул.
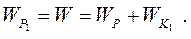 Під час максимального зближення молекул на відстань
Під час максимального зближення молекул на відстань 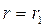 (рис. 8.1) вся їх кінетична енергія повністю витрачається на виконання роботи проти сил відштовхування (
(рис. 8.1) вся їх кінетична енергія повністю витрачається на виконання роботи проти сил відштовхування (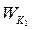 ), а їх взаємна потенціальна енергія
), а їх взаємна потенціальна енергія 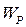 співпадає з повною енергією
співпадає з повною енергією 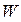 :
:
(8.6)
За всіх інших однакових умов відстань 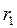 тим менша, чим більша енергія молекули, тобто чим вища температура газу. Однак при малих значеннях
тим менша, чим більша енергія молекули, тобто чим вища температура газу. Однак при малих значеннях 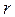 потенціальна енергія
потенціальна енергія 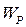 дуже швидко зростає зі зменшенням
дуже швидко зростає зі зменшенням 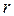 . тому навіть значна зміна температури газу викликає порівняно незначну зміну величини
. тому навіть значна зміна температури газу викликає порівняно незначну зміну величини 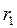 , і в першому наближенні можна прийняти, що
, і в першому наближенні можна прийняти, що 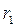 залежить лише від хімічної природи газу. Це зумовлено тим, що сили взаємного відштовхування дуже швидко зростають при зменшенні відстані між ними. Відстань
залежить лише від хімічної природи газу. Це зумовлено тим, що сили взаємного відштовхування дуже швидко зростають при зменшенні відстані між ними. Відстань 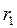 називають ефективним діаметром молекули
називають ефективним діаметром молекули 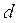 .
.
 2015-09-06
2015-09-06 2200
2200








