Зі сказаного в § 8.1 ясно, що в першому наближенні молекули реального газу можна уподібнити абсолютно твердим кулькам з діаметром 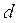 , між якими діють лише сили притягання. Враховуючи кінцеві розміри молекул, ми, таким чином, беремо до уваги дію сил взаємного відштовхування між ними.
, між якими діють лише сили притягання. Враховуючи кінцеві розміри молекул, ми, таким чином, беремо до уваги дію сил взаємного відштовхування між ними.
Така модель газу, прийнята голландським фізиком Я. Ван-дер-Ваальсом, дала йому можливість отримати рівняння стану реального газу, більш досконале, ніж рівняння Мендєлєєва–Клапейрона.
У рівнянні стану одного моля ідеального газу:
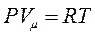 (8.7)
(8.7)
Ван-дер-Ваальс урахував власний об’єм молекул газу шляхом заміни повного об’єму 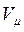 посудини з газом на так званий „вільний” об’єм:
посудини з газом на так званий „вільний” об’єм:
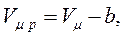 (8.8)
(8.8)
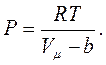 де
де 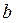 – поправка Ван-дер-Ваальса, що залежить від власного об’єму молекул:
– поправка Ван-дер-Ваальса, що залежить від власного об’єму молекул: 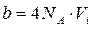 [6]. Тут:
[6]. Тут: 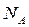 – число Авогадро,
– число Авогадро, 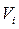 – власний об’єм однієї молекули, який залежить від природи газу. Одиниця виміру цієї поправки в системі СІ
– власний об’єм однієї молекули, який залежить від природи газу. Одиниця виміру цієї поправки в системі СІ 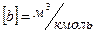 . Враховуючи лише власний об’єм молекул і не враховуючи взаємодію між ними, на підставі рівнянь (8.7) та (8.8) отримаємо:
. Враховуючи лише власний об’єм молекул і не враховуючи взаємодію між ними, на підставі рівнянь (8.7) та (8.8) отримаємо:
(8.9)
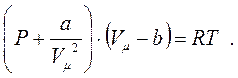 Внаслідок притяжіння між молекулами тиск газу на стінки посудини зменшується на величину
Внаслідок притяжіння між молекулами тиск газу на стінки посудини зменшується на величину 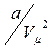 [6]. Тут
[6]. Тут 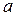 – стала, що залежить від природи газу. Одиниця виміру
– стала, що залежить від природи газу. Одиниця виміру 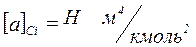 .Враховуючи поправку на тиск, отримаємо:
.Враховуючи поправку на тиск, отримаємо:
(8.10)
Це і є рівняння стану одного моля реального газу.
Щоб отримати рівняння Ван-дер-Ваальса для довільної маси 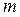 реального газу, необхідно молярний об’єм газу
реального газу, необхідно молярний об’єм газу 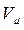 визначити через об’єм
визначити через об’єм 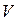 всієї маси газу (
всієї маси газу (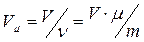 , де
, де 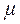 – молярна маса газу) і ліву та праву частини рівняння (8.10) домножити на кількість молів. Після таких перетворень отримаємо:
– молярна маса газу) і ліву та праву частини рівняння (8.10) домножити на кількість молів. Після таких перетворень отримаємо:
(8.11) 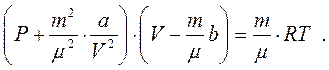
Це рівняння точніше узгоджується з результатами дослідів, ніж рівняння (8.1). Однак для дуже стиснених газів воно теж виявляється недостатньо вірним.
У випадку розріджених газів 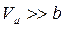 , поправка на тиск
, поправка на тиск 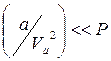 і рівняння Ван-дер-Ваальса не відрізняється від рівняння Мендєлєєва–Клапейрона.
і рівняння Ван-дер-Ваальса не відрізняється від рівняння Мендєлєєва–Клапейрона.
 2015-09-06
2015-09-06 299
299








