В химически устойчивой двухатомной молекуле между атомами действуют силы преимущественно электрического притяжения. Величина и характер этих сил зависят от перераспределения электронной плотности внешних (валентных) электронов. Рассмотрим двухатомную молекулу из образующие ее атомы с точки зрения зависимости их потенциальной энергии от расстояния между ними.
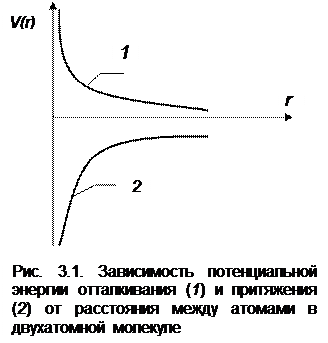 Пока атомы находятся на достаточно большом расстоянии друг от друга, сила их взаимодействия очень мала. Она появляется в результате притяжения, обусловленного взаимной поляризацией электронных оболочек атомов. Затем сила притяжения возрастает при уменьшении расстояния между атомами, однако это возрастание не беспредельно. на малых сравнительно расстояниях между атомами в действие вступают силы отталкивания, обусловленные взаимным влиянием ядер, а также проникновением электронных оболочек, что и проявляется в специфическом отталкивании между электронами. Потенциальная энергия отталкивания изображена на рис. 3.1 (кривая 1).
Пока атомы находятся на достаточно большом расстоянии друг от друга, сила их взаимодействия очень мала. Она появляется в результате притяжения, обусловленного взаимной поляризацией электронных оболочек атомов. Затем сила притяжения возрастает при уменьшении расстояния между атомами, однако это возрастание не беспредельно. на малых сравнительно расстояниях между атомами в действие вступают силы отталкивания, обусловленные взаимным влиянием ядер, а также проникновением электронных оболочек, что и проявляется в специфическом отталкивании между электронами. Потенциальная энергия отталкивания изображена на рис. 3.1 (кривая 1).
с уменьшением расстояния она возрастает быстрее, нежели энергия притяжения (кривая 2). Благодаря одновременному действию двух сил противоположного направления (сил притяжения и отталкивания) на некотором расстоянии между атомами установится равновесие: силы отталкивания равны силам притяжения. Потенциальная энергия системы, понимаемая как результирующая сумма энергий притяжения и отталкивания (рис. 3.2), будет иметь минимум. Расстояние между ядрами, которое соответствует минимуму потенциальной энергии, будем называть равновесным и обозначать 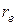 .
.
При расстоянии между ядрами меньшем равновесного, превалируют силы отталкивания, поэтому потенциальная энергия будет неограниченно и быстро возрастать (левая ветвь потенциальной кривой на рис. 3.2). При увеличении расстояния между ядрами атомов, когда r → ¥, потенциальная энергия должна расти до нуля, так как свободные атомы, удаленные на бесконечно большое расстояние друг от друга, не взаимодействуют и потенциальной энергией не обладают (правая ветвь потенциальной кривой рис. 3.2).
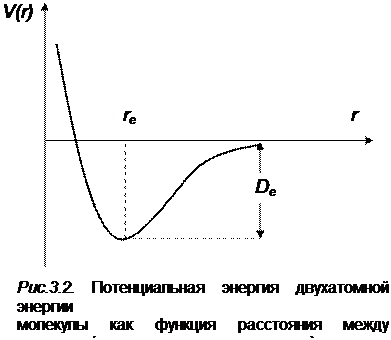 |
Потенциальная кривая V (r) весьма характерна для химической связи в двухатомной молекуле. Устойчивая молекула будет существовать в том случае, когда V (r) имеет минимум. Значение r будет находиться в интервале 0 < r < ¥. Если минимум отсутствует, то это означает, что при сближении атомов не образуется устойчивой молекулы. Первый случай соответствует притяжению атомов при их сближении, а второй – отталкиванию. Расстояние
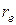 , при котором энергия взаимодействия имеет минимум, обычно принимают за длину химической связи.
, при котором энергия взаимодействия имеет минимум, обычно принимают за длину химической связи. Расстояние от минимума кривой до оси абсцисс, к которой кривая асимптотически приближается в своей правой части, соответствует работе, которую необходимо затратить для разрыва связи, а следовательно и молекулы на составляющие ее атомы или ионы и переноса их в бесконечность (диссоциации). Энергия диссоциации 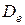 = V (r = ¥) – V (r = re) (энергия связи атомов в молекуле). Это определение энергии не учитывает значения нулевой колебательной энергии у молекулы, поэтому определенная на опыте энергия диссоциации будет меньше вычисленной.
= V (r = ¥) – V (r = re) (энергия связи атомов в молекуле). Это определение энергии не учитывает значения нулевой колебательной энергии у молекулы, поэтому определенная на опыте энергия диссоциации будет меньше вычисленной.
 2015-09-06
2015-09-06 1279
1279
