Знание вращательного спектра двухатомной молекулы позволяет вычислять равновесное межъядерное расстояние, если массы атомов m1 и m2 известны из масс–спектроскопических или других измерений. Связь между вращательной постоянной 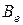 (см–1) и моментом инерции
(см–1) и моментом инерции 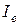 дается следующим выражением:
дается следующим выражением:
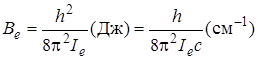 .
.
Учитывая далее, что Ie = mre2, и выражая с в см/с, Ie в кг×м2, h в Дж×с, получим
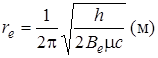 . (2.52)
. (2.52)
С той же точностью (~10–4) определяется и равновесное расстояние (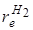 = 0,7417 А°), что превосходит точность лучших нейтронографических измерений этого расстояния.
= 0,7417 А°), что превосходит точность лучших нейтронографических измерений этого расстояния.
В качестве примера приведем расчет равновесного расстояния re для молекулы водорода. Примем следующие значения молекулярных постоянных: h = 1,626·10–34 Дж·с; Ве = 60,84 см–1; с = 2,998·1010 см·с–1; Н = 1,673·10–27; p = 3,14. Подстановка указанных значений в формулу (2.52) дает значение re = 0,07417 нм (0,7417), что совпадает с табличными данными (см. табл. 2.2). точность с которой re может быть определено для двухатомной молекулы, определяются главным образом степенью точности, с которой известна постоянная Планка h входящая в формулу (2.52). В настоящее время постоянная Планка определена с точностью (~10–4) определяется и равновесное расстояние (re Н2= 0,7417 А°), что превосходит точность лучших нейтронографических измерений этого расстояния.
С другой стороны, независимое знание равновесного расстояния в двухатомной молекуле позволяет определять спектроскопическим путем массу ядер в молекуле, если постоянная Ве известна для двух изотопических соединений (например, если измерены Ве для HCl35иHCl37, то можно довольно точно найти отношение масс изотопов Сl35иHCl37).
Действительно, из формулы
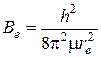 ,
,
можем записать для двух изотопических модификаций хлористого водорода следующее выражение:
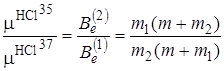 , (2.53)
, (2.53)
где m 1 – масса атома Cl35; m 2 – масса атома Cl37; m – масса атома водорода; Be (1) вращательная постоянная HCl35; Be (2) – вращательная постоянная HCl37. Из выражения (2.53) можно найти соотношение между массами двух изотопов
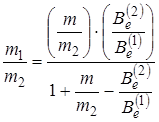 . (2.54)
. (2.54)
Соотношение между вращательными постоянными 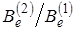 логично измерить с большой точностью, поэтому с большой точностью можно определить отношение масс m 1/ m 2. Другие физические постоянные не входят в расчетную формулу (2.54) и их точность определения не влияет на точность отношения. Таким путем было найдено отношение, которое совпадает с известными значениями, полученными другим методом (масс-спектроскопический, ядерных реакций, молекулярных пучков) с точностью до шестого знака после запятой (10–6).
логично измерить с большой точностью, поэтому с большой точностью можно определить отношение масс m 1/ m 2. Другие физические постоянные не входят в расчетную формулу (2.54) и их точность определения не влияет на точность отношения. Таким путем было найдено отношение, которое совпадает с известными значениями, полученными другим методом (масс-спектроскопический, ядерных реакций, молекулярных пучков) с точностью до шестого знака после запятой (10–6).
Существенные ошибки при измерении отношений масс по данным вращательных спектров двухатомных молекул происходят за счет неточных знаний массы m другого атома в молекуле и неопределенности в поведении электронов при вращении молекулы.
При вычислении моментов инерции молекул обычно предполагают, что каждый атом в молекуле имеет определенное число электронов и является нейтральным и что вся масса атома сосредоточена в точке. Как известно, момент инерции двухатомной молекулы записывается следующим образом:
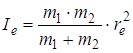 ,
,
где m 1 и m 2 – массы нейтральных атомов. Такая запись является правильной в тoм случае, если электроны имеют пренебрежимо малую массу по сравнению с ядрами (электрон легче протона в 1836 раз). Масса ядер считается сосредоточенной в пределах очень малого радиуса (порядка 10–12 см–1). Однако неопределенности в расположении и поведении электронов во вращающейся молекуле оказывают заметное влияние на момент инерции.
Электроны в молекуле в основном сконцентрированы вблизи ядер на некотором (конечном) расстоянии от них, поэтому реальные моменты инерции будут больше тех, которые получаются при расчетах в предположении, что вся масса атома сосредоточена в точке. Это увеличение приблизительно равно моменту инерции электронов относительно соответствующих ядер. Данная поправка в принципе не очень большая (порядка 10–4 см–1) почти для всех атомов, так как электронная оболочка не вращается как одно целое с молекулой. Наблюдается так называемый «эффект скольжения», который заключается в том, что при вращении молекулы сферические электронные оболочки в основном сохраняют свою неизменную ориентацию в пространстве. Но так как электронная оболочка не является полностью сферической, то необходимо учитывать частичное вращение электронного облака. Передача вращательного момента валентным электронам может возбудить их из нормального (1å - состояния) электронного состояния в возбужденное 1П – состояние, которое будет иметь несколько другую вращательную постоянную. В литературе это явление известно как разрыв L – связи под действием вращения.
Точность спектроскопических методов определения Bе. может быть легко повышена за счет использования когерентного лазерного излучения и применения спектрометров высокой разрешающей силы, однако указанные выше эффекты приводят к ограничению предельной точности определения отношения масс (она составляет величину порядка 10–6). Указанную точность пока невозможно достигнуть с помощью других методов. При определении массы атомов с указанной точностью получается ошибка порядка 10–4 единицы массы при массе атома в сотни единиц.
В случае многоатомных линейных молекул знание момента инерции I также позволяет определить расстояние между атомами. Например, линейная молекула, состоящая из трех атомов m 1, m 2, m 3, имеет момент инерции относительно центра масс, равный
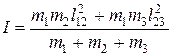 , (2.55)
, (2.55)
где 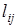 – расстояние между массами m1 и mj. Момент инерции линейной молекулы, содержащей i атомов, определяется формулой более общего вида:
– расстояние между массами m1 и mj. Момент инерции линейной молекулы, содержащей i атомов, определяется формулой более общего вида:
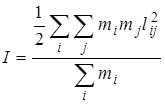 , (2.56)
, (2.56)
где i и j принимают независимо значения от 1 до i, но i ¹ j. формула будет справедлива и для определения момента инерции любой плоской молекулы относительно оси, проходящей через центр масс перпендикулярно плоскости молекулы.
В качестве примера расчета межатомных расстояний для линейных трехатомных молекул по известным вращательным спектрам рассмотрим молекулу Cl35C12N14, обладающую заметным дипольным моментом (2,80 D). Эта молекула характеризуется двумя равновесными расстояниями (r CClи r CN). Для линейной молекулы существует только один момент инерции IB относительно вращения вокруг оси, перпендикулярной оси молекулы. Определенная из спектральных данных величина В = 0,1992 см–1. Вычисляем для этого значения В момент инерции
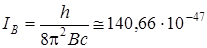 кг×м2.
кг×м2.
Однако из этого результата наблюдений нельзя определить две неизвестные величины rCCl и rCN. Трудность эту можно обойти, изучая молекулы с разными атомными массами, но с одинаковыми длинами связей, т. е. изотопно замещенные молекулы (например, Cl35C12N14 и Cl37C12N14). У таких молекул длины связей предполагаются одинаковыми, а моменты инерции будут различными. На рис. 2.13 изображена молекула ClCN, вращающаяся вокруг оси OХ, проходящей через центр тяжести перпендикулярно оси молекулы, rCl rC и rN означают расстояния соответствующих атомов от центра тяжести; m 1, m 2, m 3 – массы соответствующих атомов N, C и Cl.
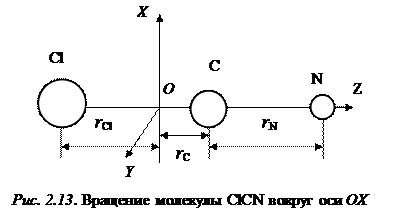
Из равенства моментов сил можем записать:
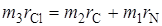 . (2.57)
. (2.57)
Момент инерции молекулы
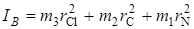 . (2.58)
. (2.58)
Учтем еще следующие очевидные соотношения
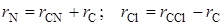 , (2.59)
, (2.59)
где r CNи r CCl – длины связей в молекуле, подлежащие определению.
Подставляя соотношения (2.59) в равенство (2.57), получим
(m 1+ m 1 + m 1)× r C= m 3× r CCl – m 1 r CN
или
M × r C = m 3× r CCl – m 1× r CN,(2.60)
где М обозначает массу всей молекулы.
Подставим (2.59) в (2.58), получим
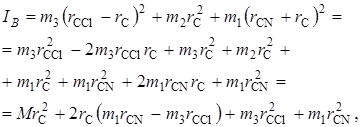 (2.61)
(2.61)
Пользуясь выражением для r (2.60), получим окончательно
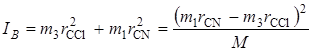 . (2.62)
. (2.62)
Для изотопно-замещенной молекулы, например Cl37CN, нужно в выражении (2.62) заменить массу атома хлора. (m 3) на его изотоп. Тогда получим новое значение момент инерции IB ':
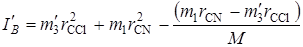 . (2.63)
. (2.63)
Величины IB и I'B определяем из вращательных спектров, а равновесные расстояния r CCl и r CN – из системы уравнений (2.62) и (2.63). Предполагается, что длина связи не изменяется при изотопном замещении. Вычисленные таким образом длины связей совпадают с экспериментально измеренными нейтронографическим и рентгеноструктурным методами. В табл. 2.4 приведены значения вращательных постоянных В некоторых трехатомных молекул, полученные из спектров, и длины равновесных расстояний, вычисленные рассмотренным выше способом.
Таблица 2.4
Вращательные постоянные (в см–1), межатомные расстояния и дипольные
 2015-09-06
2015-09-06 2588
2588
