Приборы для фиксации оптических спектров построены по единому принципу. В качестве источника УФ излучения обычно применяется "водородная лампа" (электрический разряд в атмосфере водорода при низком давлении), которая дает практически непрерывный спектр излучения в области 190-360 нм.
Для работы в видимой области служит лампа накаливания с вольфрамовой спиралью. Излучение от источника попадает в монохроматор, состоящий из зеркала, кварцевой призмы и щели. Отражаясь от зеркала, свет разлагается призмой или дифракционные решетки и затем с помощью щели из спектра выделяется узкая область. При вращении призмы спектр перемещается по отношению к щели, что позволяет получать лучи света со строго определенной длиной волны, обычно с точностью ±0,5 нм. Монохроматическое излучение пропускается через кварцевую кювету, содержащую раствор исследуемого вещества в прозрачном для УФ- области растворителе. Толщина кювет 1-10 см, наиболее распространенные кюветы имеют сечение 1´1 см, и для их заполнения требуется около 3 мл раствора. Интенсивность прошедшего через кювету света измеряется с помощью фотоэлемента, величина тока которого пропорциональна интенсивности падающего света. Ток усиливается и регистрируется потенциометром.
Сравнивается интенсивность светового луча, прошедшего через исследуемый раствор, и луча, пропущенного через аналогичную кювету с чистым растворителем. Получаемая разность соответствует поглощению растворенного исследуемого вещества.
Такое сравнение может быть проведено двумя путями. При наличии одного светового луча на его пути попеременно ставят кювету с исследуемым раствором и с растворителем (кювету сравнения). Спектр строят по точкам, постепенно вручную настраивая прибор на определенные длины волн. В современных регистрирующих приборах световой поток делится на два одинаковых пучка, один из которых проходит через исследуемый раствор, а другой - через растворитель, причем как сравнение интенсивностей прошедших через кюветы световых потоков, так и непрерывное изменение длин волн производится автоматически. В том и другом случае получают спектр вещества, представляющий собой зависимость оптической плотности раствора (D) от длины волны поглощаемого света:
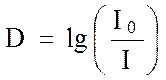
В точках максимумов молярный коэффициент погашения вычисляют по формуле
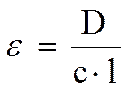
Спектр в большинстве случаев представляет собой кривую с одним пологим максимумом. Большая ширина полосы поглощения обусловлена тем, что помимо основных уровней электронных переходов существуют подуровни, связанные с колебаниями молекулы. Многочисленность таких подуровней обычно приводит к тому, что соответствующие им отдельные максимумы сливаются в один, имеющий пологую форму. В отдельных случаях, например для ароматических соединений, за счет колебательных подуровней максимум поглощения представляет собой набор узких полос по обе стороны от основной. В таких случаях принято говорить, что максимум имеет тонкую структуру.
Приборы различных схем позволяют получать спектры в различных областях спектра. В УФ области поглощают все органические вещества. Длины волн менее 190 нм (дальняя, или вакуумная область УФ спектра) малопригодны для работы, так как в этой области поглощают компоненты воздуха - кислород и азот. Приборы для исследований в интервале длин волн 120-190 нм с вакуумными камерами существуют, однако они сложны и редко используются в обычной лабораторной практике; существуют схемы, где влияние газов воздуха ликвидируют продувкой полостей, по которым проходит луч непоглощающим газом.
Для волн длиной более 200 нм воздух прозрачен, что делает ближнюю ультрафиолетовую и видимую области спектра (190-800 нм) удобными для измерений. В том же интервале прозрачен кварц, который в УФ спектроскопии применяется как оптический материал для изготовления призм и кювет. Приборы для получения спектров поглощения в этой области просты и доступны. Необходимые для исследования количества вещества невелики - около 0,1 мг. В связи с этим УФ спектроскопия в настоящее время является одним из наиболее распространенных физико-химических методов исследования органических соединений.
Поглощение органическими веществами электромагнитных колебаний в ультрафиолетовой (УФ) и видимой области обусловлено переходом электронов со связывающих орбиталей на разрыхляющие или несвязывающие орбитали; такое состояние молекулы называется возбужденным.
При взаимодействии с квантом света электрон, поглощая энергию, может переходить с высшей заполненной орбитали на низшую вакантную орбиталь. Электроны достаточно прочно удерживаются ядром, поэтому для их возбуждения требуются большие энергии и, следовательно, электромагнитное излучение, имеющее малые длины волн (120 - 800 нм).
Электроны в атомах и молекулах занимают орбитали со строго определенной энергией. Уровень энергии атомных орбиталей определяется соответствующим набором квантовых чисел. Молекулярные орбитали могут рассматриваться как линейные комбинации атомных. Такая комбинация дает связывающую орбиталь (¯, электроны с антипараллельными спинами, нормальное состояние) и разрыхляющую орбиталь (, электроны с параллельными спинами, возбужденное состояние).

В обычных органических молекулах присутствуют электроны s - и p -связей, а также электроны неподеленных пар гетероатомов, или n -электроны. Их относительные энергетические уровни и сравнительные энергии возможных переходов в возбужденное состояние представлены на рис. 4, из которого следует, что наибольшая энергия кванта необходима для осуществления перехода s®s*, т.е. для возбуждения электронов наиболее прочной s -связи необходимы кванты света минимальной длины волны. Энергия переходов n®s* и p®p* меньше, и, следовательно, длина волны света, возбуждающего такой переход, соответственно больше. Энергия n -уровня электронов выше энергии p -уровней, поэтому возбуждение вызывается квантами света еще большей длины волны. Практическое значение имеют переходы n ®p* и p®p*, поскольку только им соответствуют длины волн, попадающие в рабочий диапазон прибора. Исключение составляют переходы p®p* изолированных двойных связей С=С и C=N, а также тройных связей 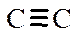 и
и 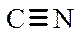 (lмакс 160-180 нм). Для изолированных кратных связей в используемом для измерений интервале проявляется только переход карбонильной группы С=О (lмакс» 270 нм).
(lмакс 160-180 нм). Для изолированных кратных связей в используемом для измерений интервале проявляется только переход карбонильной группы С=О (lмакс» 270 нм).
Группировки, вызывающие избирательное поглощение электромагнитного колебания в УФ- области, называются хромофорами. Основными хромофорами, дающими максимум поглощения в области 200-800 нм, являются системы сопряженных двойных связей. Орбитали, образуемые двумя сопряженными двойными связями, представлены на рис. 5.
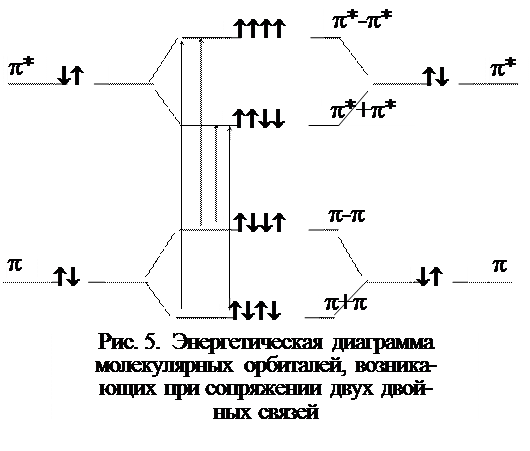
Из рисунка очевидно, что при взаимодействии двух p - орбиталей, соответствующих изолированным двойным связям, образуются две новые орбитали: связующая (p+p) и разрыхляющая (p-p). Возбужденному состоянию также соответствуют две орбитали. Следовательно, для возбуждения электронов сопряженной системы, т.е. для осуществления перехода с высшей заполненной (p-p) на низшую вакантную (p*+p*) орбиталь, требуется меньшая энергия, чем для возбуждения электронов изолированных двойных связей (p®p*), так что сопряженные двойные связи будут поглощать кванты света с большей длиной волны, чем изолированные двойные связи. С ростом числа сопряженных двойных связей энергия, необходимая для возбуждения электронов, будет уменьшаться, и поглощение света будет наблюдаться при больших длинах волн.
Интенсивность поглощения в спектре связана с вероятностью данного типа электронного перехода. Однако далеко не все переходы, формально кажущиеся возможными, осуществляются в действительности. Существуют так называемые правила отбора, определяющие разрешенные и запрещенные переходы. Эти правила учитывают в основном симметрию молекулы, а также электронную симметрию основного и возбужденного состояний; запрещены переходы, при которых происходит изменение спина электрона. Интенсивность поглощения, соответствующего разрешенным переходам, обычно высока, мольный коэффициент погашения достигает тысяч, а иногда и сотен тысяч единиц, тогда как для запрещенных переходов значение e составляет десятки, реже - сотни единиц.
Различные области спектра дают различную информацию. УФ спектры дают важную информацию о наличии кратных и сопряженных связей, ИК спектры позволяют наблюдать многочисленные проявления различных молекулярных группировок, ЯМР- и ЭПР- спектры позволяют исследовать тонкие детали механизмов взаимодействия в реакциях. Поэтому всегда важно использовать различные спектральные методы в комплексе.
 2015-09-06
2015-09-06 2427
2427








