(закон сохранения энергии для тепловых явлений)
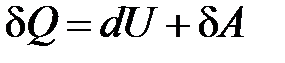 ,
, 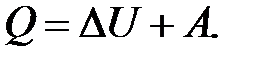
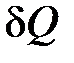 и
и 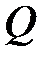 – бесконечно малое и конечное количество тепла, подводимое к системе.
– бесконечно малое и конечное количество тепла, подводимое к системе.
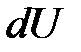 и
и 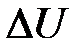 – бесконечно малое и конечное приращение внутренней энергии системы.
– бесконечно малое и конечное приращение внутренней энергии системы.
 и
и 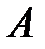 – бесконечно малая и конечная работа, совершаемая системой против внешних сил,т. е. над внешними телами. Все переменные могут быть как положительными, так отрицательными и нулевыми.
– бесконечно малая и конечная работа, совершаемая системой против внешних сил,т. е. над внешними телами. Все переменные могут быть как положительными, так отрицательными и нулевыми.
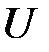 – внутренняя энергия системы[Дж]: сумма кинетической энергии хаотического движения молекул, потенциальной энергии взаимодействия между молекулами и внутримолекулярной энергии. Система, находящаяся в одном и том же состоянии (набор
– внутренняя энергия системы[Дж]: сумма кинетической энергии хаотического движения молекул, потенциальной энергии взаимодействия между молекулами и внутримолекулярной энергии. Система, находящаяся в одном и том же состоянии (набор  ,
, 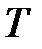 ,
, 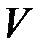 для идеального газа ), имеет одну и ту жевнутреннюю энергию
для идеального газа ), имеет одну и ту жевнутреннюю энергию 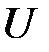 , т. е.
, т. е. 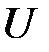 – функция состояния системы.
– функция состояния системы.  – тепло [Дж],
– тепло [Дж], 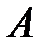 – работа [Дж].
– работа [Дж].
Моль –количество вещества, в котором содержится 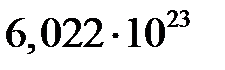 частиц.
частиц.
Идеальный газ – система не взаимодействующих друг с другом частиц.
Параметры состояния системы – давление  , температура
, температура 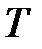 , объем
, объем 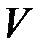 и т. д.
и т. д.
Равновесное состояние – все параметры системы имеют определенные значения, не меняющиеся при неизменных внешних условиях.
Равновесный (квазиравновесный) процесс – бесконечно медленный процесс, состоящий из последовательности равновесных состояний. Такой процесс – обратимый. Неравновесный процесс – необратимый.
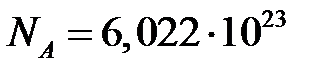 моль-1 – число Авогадро,
моль-1 – число Авогадро, 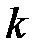 –постоянная Больцмана [Дж/K],
–постоянная Больцмана [Дж/K],  – газовая постоянная [Дж/К
– газовая постоянная [Дж/К  моль],
моль], 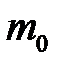 – масса молекулы [кг],
– масса молекулы [кг],  – число частиц вещества,
– число частиц вещества,  – масса вещества [кг],
– масса вещества [кг], 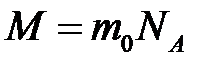 – молярная масса [кг∙моль-1],
– молярная масса [кг∙моль-1], 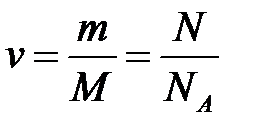 – число молей вещества [моль].
– число молей вещества [моль].
 2015-09-06
2015-09-06 591
591








