Рассмотрим пример гидролиза подобной соли:
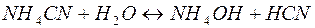
В общем виде эта реакция может быть представлена уравнением:
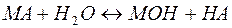 (23)
(23)
Отдельно гидролиз по катиону и по аниону следует уравнениям:
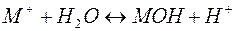
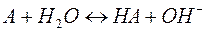
Можно видеть, что в результате гидролиза образуются и катионы водорода, и анионы гидроксида. Нетрудно показать, что константа гидролиза является функцией констант диссоциации продуктов гидролиза – слабого основания (МОН) и слабой кислоты (НА):
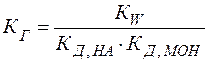 (24)
(24)
Степень гидролиза 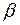 и концентрация
и концентрация 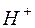 в этом случае не зависят от исходной концентрации соли:
в этом случае не зависят от исходной концентрации соли:
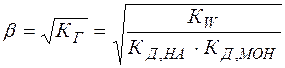 (25)
(25)
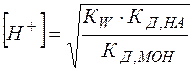 (26)
(26)
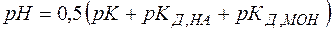 (27)
(27)
Из выражений (26), (27) видно, что в зависимости от соотношения между кислотностью и основностью продуктов гидролиза (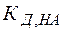 и
и 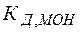 ) среда может приобретать либо кислую, либо щелочную реакцию.
) среда может приобретать либо кислую, либо щелочную реакцию.
Ионно-молекулярные реакции обмена имеют важное значение в аналитической химии, в препаративном неорганическом анализе, а также при получении ряда ценных неорганических соединений. В то же время эти реакции занимают заметное место в процедуре подготовки воды, являющейся важной стадией во многих технологических процессах. Целью этой процедуры является снижение содержащихся в природных водах солей кальция, магния и железа.
 2015-10-14
2015-10-14 670
670








