Из молекулярных методов диагностики наибольшее распространение получила полимеразная цепная реакция (ПЦР). Предложенный в 1983 году американским биохимиком Керри Маллисом метод ПЦР в корне изменил подход в молекулярной диагностике наследственных и инфекционных заболеваний, судебно-медицинской экспертизе вещественных доказательств, установлении родства и анализе родословных, систематике микроорганизмов, растений, животных и т.д. За изобретение ПЦР К.Маллис в 1993 г. был удостоен Нобелевской премии.
Полимеразная цепная реакция – наиболее точный метод на сегодняшний день метод исследований по генной диагностики. Принцип метода заключается в том, что по данным банка генов различных организмов выявляется специфический для данного организма (бактериальной клетки, вируса) ген – участок молекулы ДНК, несущий информацию для синтеза одного белка. К участкам данного гена синтезируются затравки - праймеры, длиной 15-25 нуклеотидов.
ПЦР является надежным, высокочувствительным методом, хорошо защищенным от ложноположительных и ложноотрицательных результатов. В модельной системе при диагностике вирусных инфекций удается регистрировать порядка 10 геномов в пробе (Виноградская P.P. и др., 1991 г.). Считают, что предел чувствительности ПЦР-диагностикума при условии использования 100 мкл необогащенного клинического образца в качестве пробы составляет 10-10 возбудителей в 1 мл. Такой чувствительности достигают только культуральные методы диагностики. ПЦР имеет преимущество перед культуральными методами для обнаружения возбудителей болезней, которые не удается выращивать в лабораторных условиях.
Суть полимеразной цепной реакции (рис. 12.6) заключается в том, что молекулу ДНК подвергают температурному плавлению, то есть нагревают до 90-94о C, что ведет к денатурации – разрушению водородных связей между азотистыми основаниями двойной спирали, а затем охлаждают (отжиг) до 52°С в присутствии праймера, фермента ДНК-полимеразы и всех четырех дезокситрифосфатов.
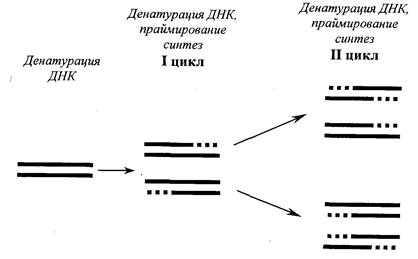
Рис. 12.6 Схематическое изображение амплификации молекулы ДНК при плавлении (денатурации) и отжиге (синтезе) новой молекулы ДНК в присутствии затравки (праймера), фермента ДНК-полимеразы и трифосфатов.
▬ праймер
▪ ▪ ▪ ▪ новосинтезированная молекула ДНК
Последующее повышение температуры до 70-72°С приводит к синтезу новой молекулы ДНК, комплементарной к матричной. Эту процедуру плавления, отжига и синтеза ДНК повторяют многократно, в результате чего количество выбранного фрагмента ДНК увеличивается в геометрической прогрессии (рис. 12.6).
Специфичность метода уникальна, так как она обусловлена последовательностью нуклеотидов затравки (праймера) и в зависимости от цели исследования можно выявить вид, группу видов или род микроба. Так, использовав в качестве праймера олигонуклеотид гена gro El микобактерий можно установить наличие в образце представителей любого из 30 видов рода Mycobacteria; праймера IS 986 (или IS6110) – представителей любого из четырех видов – возбудителей туберкулеза человека, относящихся к M.tuberculosis Complex; праймер к IS 900 выявит один единственный вид – Mycobacterium paratuberculosis (Ланцев В.А и др., 1993 г.).
Продолжительность реакции определяется числом циклов, необходимых для синтеза ДНК-амплификата в количестве, достаточном для дальнейшего исследования или индикации. Индикация может быть осуществлена с помощью электрофореза или с помощью меченого ДНК-зонда.
 2015-10-16
2015-10-16 644
644








