Пуриновые и пиримидиновые нуклеотиды — мономеры нуклеиновых кислот — представляют собой одни из наиболее сложно организованных метаболитов. Их синтез de novo требует участия большого количества ферментов и затрат энергии, однако может осуществляться всеми организмами, за исключением некоторых ауксотрофных мутантов микроорганизмов. Ввиду особой сложности синтеза нуклеотидов их разрушение (например, при расщеплении ненужных нуклеиновых кислот) обычно происходит не полностью, а до определенных составных частей. Эти составные части (в первую очередь, пуриновые азотистые основания) могут снова участвовать в образовании нуклеозидмонофосфатов. Такое явление носит название ресинтез.
При полном расщеплении пуриновых и пиримидиновых нуклеотидов образуются фосфорная кислота, углекислота и аммиак, при неполном—рибоза (или рибозо-5-фосфат), азотистые основания, мочевина, аллантоиновая кислота, аллантоин и мочевая кислота. Как правило, самые низкоорганизованные формы живого (например, бактерии) обладают способностью к полному расщеплению нуклеотидов, а организмы, занимающие более высокие ступени эволюционной лестницы, расщепляют нуклеотиды и входящие в их состав азотистые основания до менее простых соединений.
Биосинтез нуклеотидов. В этом процессе принимают участие аминокислоты, которые служат источниками большинства атомов углерода и всех атомов азота в составе азотистых оснований. Синтез пуриновых и пиримидиновых нуклеотидов происходит различными путями.
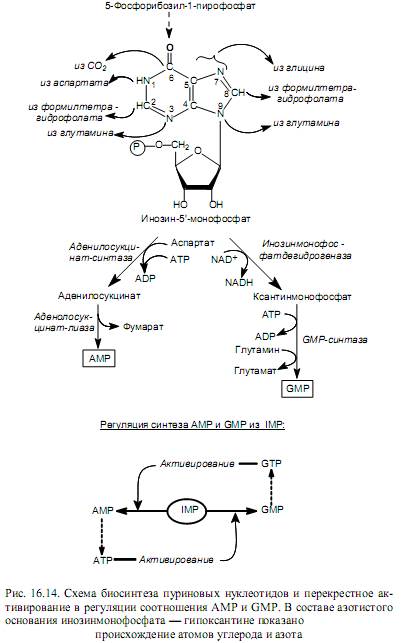
Биосинтез пуриновых нуклеотидов de novo начинается с постепенного наращивания кольца азотистого основания на молекуле 5-фосфорибозил-1-пирофосфата, который также участвует в биосинтезе гистидина и триптофана (рис.16.10). Вначале к фосфорибозилпирофосфату в реакции трансаминирования присоединяется аминогруппа (N-9), донором которой является глутамин. Затем в состав пятичленного кольца включается два атома углерода (C-4, C-5) и атом азота (N-7), берущие происхождение из глицина, а также атом углерода (C-8) от формилтетрагидрофолиевой кислоты. После этого последовательно присоединяются компоненты шестичленного кольца: атом азота (N-3) из глутамина, атом углерода (C-6) из СО2, атом азота (N-1) из аспартата и атом углерода (С-2) из формилтетрагидрофолиевой кислоты. На последнем этапе замыкается шестичленное кольцо и формируется молекула основного промежуточного продукта биосинтеза пуринов — инозин-5`-монофосфата (IMP). Этот метаболит затем превращается в АМР и GMP (рис.16.14).
Синтез пуриновых нуклеозидмонофосфатов регулируется аллостерически: ADP и GDP тормозят процесс образования фосфорибозилпирофосфата, а AMP и GMP ингибируют активность первого фермента, катализирующего образование кольца азотистого основания—амидофосфорибозилтрансферазы (реакция трансаминирования). Таким образом происходит саморегуляция образования пуриновых нуклеотидов, не допускающая их «перепроизводства». Кроме этого, регулируется соотношение между двумя пуриновыми нуклеотидами, образующимися из инозинмонофосфата, с помощью перекрестного активирования (рис. 16.14).
Пуриновые нуклеозидмонофосфаты превращаются в нуклеозиддифосфаты с участием нуклеозидмонофосфаткиназ:
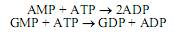
Образующийся в этих реакциях ADP может превращаться в АТР в процессах субстратного и окислительного фосфорилирования, а также фотофосфорилирования. Гуанозиндифосфат превращается в гуанозинтрифосфат при участии нуклеозиддифосфаткиназы:
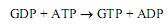
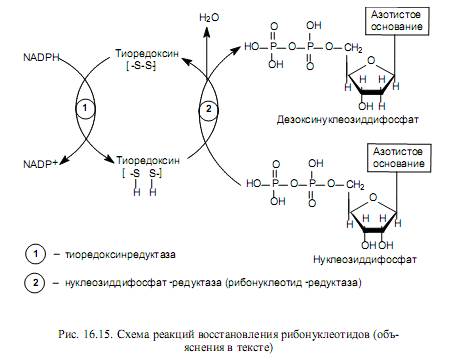
Рибонуклеотиды превращаются в дезоксирибонуклеотиды на стадии нуклеозиддифосфатов в реакции восстановления. Эта многоступенчатая реакция катализируется двумя ферментами: тиоредоксинредуктазой и нуклеозиддифосфатредуктазой (рибонуклеотид-редуктаза). Донором водорода для восстановления остатка рибозы служит NADPH, который, однако, не переносит водород непосредственно на рибозу, а восстанавливает особый белок—тиоредоксин. В составе молекулы тиоредоксина при этом расщепляется дисульфидный мостик, и образуются 2 сульфгидрильные группы, которые и участвуют в восстановлении атомов углерода рибозы (рис. 16.15). Нуклеозиддифосфат-редуктаза катализирует ототщепление молекулы воды от остатка рибозы с помощью образующегося в ее активном центре тирозин-радикала. В результате субстрат превращается в радикал-катион, который восстанавливается в дезоксирибонуклеотид при участии тиоредоксина, а в активном центре фермента регенерируется тирозиновый радикал.
Рибонуклеотид-редуктаза аллостерически активируется АТР и ингибируется dАТР (дезоксиаденозинтрифосфат), что позволяет регулировать соотношение окисленных и восстановленных форм нуклеозиддифосфатов.
Биосинтез пиримидиновых нуклеотидов de novo осуществляется так: вначале синтезируется пиримидиновое кольцо, а затем к нему присоединяется рибозо-5-фосфат. Синтез пиримидинового кольца происходит с участием карбамоилфосфата и аспартата. В свою очередь, карбамоилфосфат образуется в цитоплазме из углекислоты и глутамина (донор аминогруппы) и катализирует эту реакцию карбамоилфосфат-синтаза, гидролизующая глутамин.
При конденсации карбамоилфосфата и аспартата (фермент — аспартаткарбамоилтрансфераза) формируется шестичленное кольцо — дигидрооротат. Его окисление в оротат и присоединение фосфорибозилпирофосфата приводит к образованию оротидин-5- монофосфата, декарбоксилирование которого дает основное промежуточное соединение биосинтеза пиримидинов—уридин-5-монофосфат (UMP). UMP затем превращается в другие пиримидиновые нуклеотиды (рис. 16.16) довольно сложным образом.
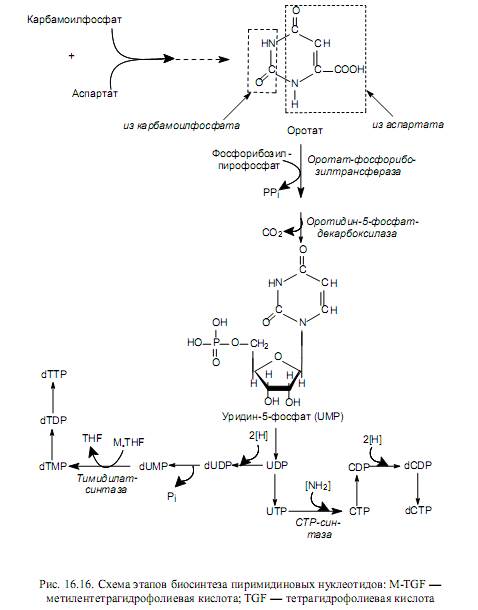
Пиримидиновые нуклеозидтрифосфаты образуются из нуклеозидмоно фосфатов при участии АТР, как это описано выше для пуриновых нуклеотидов. Цитидилат образуется из уридилата на уровне нуклеозидтрифосфатов (рис. 16.16) при участии цитидинтрифосфат-синтазы. Дезокситимидилат возникает из уридилата на уровне нуклеозидмонофосфата при метилировании дезоксиуридинмонофосфата. Эту реакцию катализирует тимидилат-синтаза при участии донора метильных групп—метилентетрагидрофолата. Восстановление рибонуклеотидов в дезоксирибонуклеотиды осуществляется по описанному ранее (для пуринов) механизму (рис. 16.15).
Регуляция биосинтеза пиримидиновых нуклеотидов у бактерий описана ранее (глава 6), и она осуществляется в ходе аллостерической регуляции активности фермента — аспартат-карбамоилтрансферазы. У животных ключевым ферментом биосинтеза пиримидиновых нуклеотидов является карбамоилфосфатсинтаза, которая аллостерически активируется АТР и фосфорибозилпирофосфатом, а ингибируется UTP.
Итак, рассмотрен синтез пуриновых и пиримидиновых нуклеотидов de novo. Однако это не единственный способ их образования, в целях экономии ресурсов клетки часто образуют нуклеотиды в ходе так называемого ресинтеза. Этот путь предполагает использование свободных пуриновых и пиримидиновых азотистых оснований, которые образуются при расщеплении нуклеиновых кислот, и фосфорибозилпирофосфата. Реакции образования нуклеозидмонофосфатов катализируются соответствующими фосфорибозилтрансферазами. Такой способ синтеза нуклеотидов особенно характерен для клеток злокачественных опухолей.
Расщепление нуклеотидов. Данный процесс обычно завершает расщепление нуклеиновых кислот, которое катализируется нуклеазами. Различают два типа нуклеаз — экзонуклеазы (атакуют полинуклеотидные цепи с концов) и эндонуклеазы (осуществляют расщепление ковалентных связей внутри молекулы, не нуждаясь в свободных 3`- и 5`-концах). Результатом деятельности нуклеаз является образование свободных нуклеотидов.
Пуриновые и пиримидиновые нуклеотиды расщепляются разными путями: пуриновое кольцо остается незатронутым и превращается в мочевую кислоту либо продукты ее преобразования, которые выводятся из организма; пиримидиновые азотистые основания разрушаются до небольших фрагментов, которые способны снова включаться в метаболизм или могут выводиться из организма.
У приматов, в том числе человека, птиц и рептилий распад пуриновых нуклеотидов сопровождается образованием рибозо-фосфата (участ-вует в метаболизме) и мочевой кислоты (выводится с мочой). У других млекопитающих и моллюсков мочевая кислота окисляется в аллантоин, который выводится из организма. У костистых рыб аллантоин гидратируется в аллантоинат, а у амфибий и хрящекостных рыб аллантоинат расщепляется до мочевины и глиоксилата. Наконец, в клетках микроорганизмов пуриновые нуклеотиды могут расщепляться до простейших соединений — аммиака, углекислоты, глицина, муравьиной кислоты. На рис.16.17 показаны упрощенные схемы расщепления пуриновых нуклеотидов.
Важно отметить, что превращения гипоксантина в ксантин и ксантина в мочевую кислоту катализирует один и тот же фермент — ксантин-оксидаза, и на каждой из этих стадий в субстрат вводится оксогруппа в ходе окисления молекулярным кислородом. При этом в качестве другого продукта образуется перекись водорода (рис. 16.17), токсичное действие которой нейтрализуется ферментами пероксидазами.
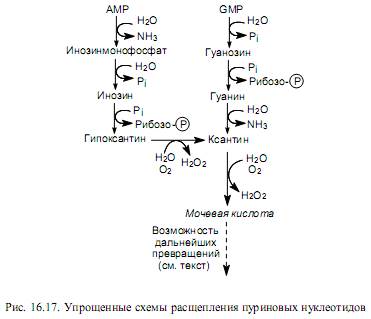
Мочевая кислота, в составе которой пуриновые азотистые основания выводятся из организма человека, в отличие от мочевины плохо растворима в воде. Поэтому при некоторых нарушениях метаболизма, в том числе отдельных наследственных заболеваниях, а также при чрезмерном употреблении мясных продуктов, содержащих высокие концентрации пуринов, в крови повышается концентрация мочевой кислоты (гипер-урикемия). Следствием этого может являться отложение мочевой кислоты в суставах (подагра) и других органах.
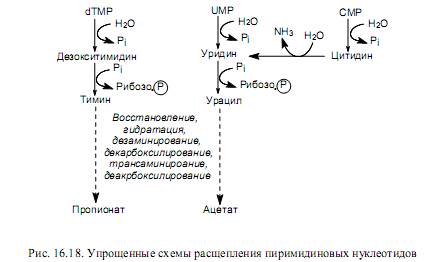
При расщеплении пиримидиновых нуклеотидов вначале происходит отщепление остатка фосфорной кислоты и образование нуклеозида, а затем тимидин и уридин расщепляются до более простых соединений (рис. 16.18) в ходе нескольких, общих для этих нуклеозидов реакций. Важными промежуточными соединениями этих путей являются урацил и тимин, которые могут участвовать в ресинтезе пиримидиновых нуклеотидов или расщепляться одинаковым способом: пиримидиновое кольцо вначале восстанавливается, а затем гидролитически расщепляется.
Следует отметить, что одна из аминогрупп пиримидиновых азотистых оснований отщепляется в процессе гидролитического дезаминирования, а вторая — в ходе трансаминирования, при котором акцептором аминогруппы служат a-кетоглутарат (превращается в глутамат) или пируват (превращается в аланин). Кроме ацетата и пропионата, продуктами расщепления пиримидиновых нуклеотидов являются СО2 и NH3.
 2015-10-16
2015-10-16 5209
5209
