Самым лучшим методом, позволяющим выяснить расположение в трехмерном пространстве белковой молекулы, является рентгеноструктурный анализ кристаллов белка. Кристаллизация белков - это достаточно трудоемкая процедура. Белок для этого должен быть очень чистым (гомогенным). Из него готовится насыщенный раствор (около 10 мг белка/мл), который выдерживается до образования в нем кристаллов. В кристалле белковые молекулы формируют очень правильную решетку. Эта кристаллическая решетка напоминает 3-хмерную мозаику.
Такой кристалл помещают на пути пучка g-лучей. g-частицы, проходя через кристаллическую решетку, сталкиваются с атомами молекулы белка и изменяют свою траекторию. В результате возникает вторичное g-излучение, которое фиксируется на фотопластинке. Кристалл белка поворачивают на определенный угол и снова пропускают через него g-лучи. На фотопластинках с дифракционными картинами вторичного g-излучения измеряется расстояние между пятнами, а с помощью компьютера формируют карту электронной плотности. Затем специальным математическим методом, получившим название "трансформация Фурье", карту преобразуют в структурную модель белка.
Именно таким методом пользовались американские исследователи Л. Поллинг и Р. Кори, исследуя ди- и трипептиды. Измерения ими расстояний между атомами пептидной группировки показали, что пептидная связь в белках является практически плоской. Её основные параметры приведены на рис.1.23. Пептидная связь примерно на 10% короче обычной, простой С-N и имеет характер частично двойной связи -С=N-, которая ограничивает подвижность атомов, прилежащих к ней. Это обусловлено взаимодействием неподеленной пары электронов атома азота с p-электронной системой карбонильной группы, что приводит к затрудненному вращению вокруг связи С-N.
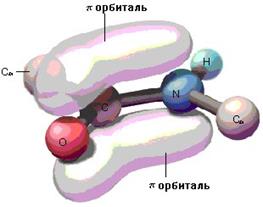 | 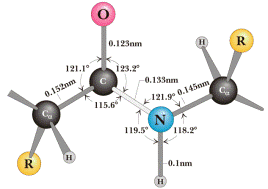 |
| Рис.1.23. Пространственное изображение пептидной связи |
Из обнаруженных особенностей в строении пептидной связи вытекали три постулата или принципа, сформулированные Л.Поллингом и Р.Кори:
1. Атомы, образующие пептидную связь, копланарны (лежат в одной плоскости). Вращение атомов или групп атомов вокруг пептидной связи невозможно или чрезвычайно затруднено;
2. Принцип эвивалентности вклада аминокислотных остатков в образование пептидной связи и, тем самым, в образование полипептидной цепи (за исключением Про).

 3. Принцип максимума водородных связей. В белках атомы водорода и кислорода практически всегда располагаются в транс-конформации. Это обусловливает возможность образования в полипептидной цепи максимума водородных связей (рис.1.24).
3. Принцип максимума водородных связей. В белках атомы водорода и кислорода практически всегда располагаются в транс-конформации. Это обусловливает возможность образования в полипептидной цепи максимума водородных связей (рис.1.24).
Если пептидные связи "жесткие", плоскостные, то участки полипептидной цепи между Сa - С и N - Сa конформационно подвижны. В результате стремления боковых радикалов аминокислотных остатков выйти из заслонения формируется правозакрученная спиралевидная конформация полипептидной цепи или иная конформация[3].
 2015-10-16
2015-10-16 1214
1214








