Возможность наработки белков или пептидов в лабораторных или промышленных условиях имеет исключительное значение. Во-первых, это позволяет подтвердить правильность определения их первичной структуры. Во-вторых, синтетическая модификация аминокислотного состава и последовательности пептидных молекул позволяет выяснить механизм их биологического действия, определить функциональную принадлежность отдельных участков пептидных молекул. Одним из наиболее многообещающих приложений полипептидного синтеза является создание лекарственных препаратов (инсулин человека), синтетических вакцин. Последние имеют ряд преимуществ перед вакцинами, приготовленными из "убитых" (инактивированных) или аттенуированных ("живые", но в результате мутации утратили способность вызывать заболевание у человека) вирусов. Использование таких вакцин всегда имеет определенный риск из-за вероятности развития заболевания, связанной с наличием в ней живых и мутировавших вирусов. Эти проблемы отсутствуют, если вакцину приготавливают из синтетических полипептидов, содержащих последовательность аминокислот, которая ответственна за антигенные свойства вирусов (тем самым они стимулируют иммунную систему к выработке антител против них).
Химический синтез полипептидов заключается в последовательном ковалентном связывании аминокислот, по одной за каждый цикл реакций, начиная с С-конца по направлению к N-концу. Это означает, что по завершении каждого цикла у растущей полипептидной цепи на N-конце будет свободная аминогруппа. Чтобы образовалась новая пептидная связь между этой группой и карбоксильной группой новой аминокислоты, аминогруппа этой аминокислоты должна быть заблокирована. В противном случае она будет реагировать с другими группами или с a-аминогруппой N-концевой аминокислоты растущей полипептидной цепи. Как только новая аминокислота присоединиться к полипептидной цепи, её аминогруппа должна быть деблокирована для образования следующей пептидной связи. Если такие превращения проводятся в растворе, выход синтезированного полипептида невелик. Уж очень большие потери происходят выделения и очистки продуктов реакции. Этот недостаток успешно преодолел в 1962 г. Брюс Меррифилд, предложив схему твердофазного синтеза (см. рис.1.22).
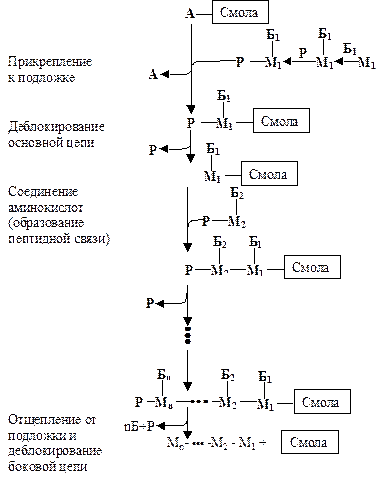
Рис.1.22. Схематическое изображение синтеза полипептида твердофазным методом
А - активирующая группа; М - остаток аминокислоты, встраиваемый в полипептидную цепь; Б - блокаторы групп в составе аминокислотного радикала; Р - блокаторы групп растущей полипептидной цепи
В соответствии с этим методом наращивание полипептидной цепи происходит на нерастворимой подложке (частицы полистиреновой смолы), с которой эта цепь ковалентно связана обычно своим С-концом. В зону синтеза последовательно вносят соответствующие аминокислоты с заблокированными аминогруппами и другие реагенты. При этом количественный выход и очистку промежуточных продуктов осуществляют простым фильтрованием и промыванием частиц смолы.
Биоинженерный способ синтеза белков и пептидов (см. метод клонирования в гл. 13).
 2015-10-16
2015-10-16 4289
4289
