Можно выделить следующие этапы выяснения первичной структуры белков и пептидов:
1. Выделение белка в чистом виде и определение его молекулярной массы
2. Определение аминокислотного состава
3. Определение N-концевой аминокислоты
4. Определение С-концевой аминокислоты
5. Определение аминокислотной последовательности
Выделение белка в чистом виде. Как правило, исходный материал содержит много различных белков. В связи с этим возникает проблема выделения из этой смеси интересующего белка в чистом виде. При очистке белков используются методы, которые основаны на разнице:
1. Поверхностного заряда белков
2. Молекулярного размера белков (зависящего от их молекулярной массы)
3. Биологической активности вследствие связывания с субстратами или ингибиторами
Разделение белков по разнице величины поверхностного заряда. Суммарный поверхностный электрический заряд белка при данном значении рН может быть отрицательным, нейтральным или положительным. Для разделения белков с различным зарядом, подобно тому, как это было в случае аминокислот, может быть использован метод ионообменной хроматографии (см. выше). Концентрацию белка в пробирках с элюатом определяют с помощью спектрофотометра по интенсивности поглощения ультрафиолетового света и строят графическую зависимость её от объема вытекшей из хроматографической колонки жидкости.
Разделение белков по молекулярной массе. Если представить молекулы белков в виде шариков различной величины, размер которых зависит от их молекулярной массы, то окажется, что у больших шариков будет большей молекулярная масса или размер молекул. Это означает, что белки можно разделить подобно частичкам в сите - молекулярном сите, образованном гелем. Такой способ часто называют гель-фильтрацией или хроматографией исключения размером. Ниже приводится иллюстрация того, как с помощью гель-фильтрации удается разделить смесь белков различного размера (рис.1.12).
Хроматографическую колонку заполняют набухшим гелем. Частицы геля приготовлены из связанного поперечными сшивками полисахаридного материала и содержат большое количество микропор. Размер микропор подбирают таким образом, чтобы в них проникали меньшие из разделяемых молекул, в то время как большие этого сделать не могли. Смесь разделяемых белков наносят на верхнюю часть колонки и элюируют буферным раствором. Увлекаемые током нисходящей жидкости большие молекулы, не имея возможности проникнуть в поры гелевых частиц, будут двигаться быстрее. Меньшие молекулы проникают в поры и задерживаются там. Если собирать вытекающий из колонки раствор равными порциями в пробирки, то окажется, что в более ранних порциях вытекающей жидкости будут содержаться белки больших размеров, а в более поздних - меньших размеров. Путем подбора размера пор можно добиться разделения самых разных смесей белков.
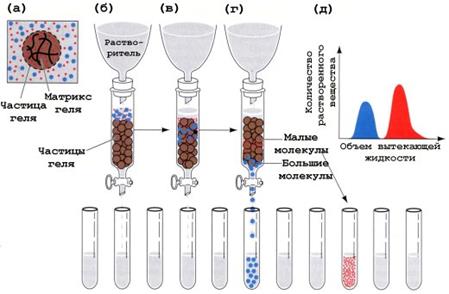
Рис.1.12. Схематическое изображение разделения белков методом гель-фильтрации
Если учесть, что размер молекулы зависит от молекулярной массы, то оказывается, что разделяя белки методом гель-фильтрации, одновременно можно установить его молекулярную массу.

Рис.1.13. График зависимости молекулярной массы белков от объема выхода их из хроматографической колонки в ходе гель-фильтрации
Объем вытекающего из колонки элюата обратнопропорционален логарифму молекулярной массы белка. Таким образом, достаточно знать объем жидкости, в котором вышел из колонки интересующий белок, чтобы, пользуясь подобным графиком, можно было установить его молекулярную массу (рис.1.13).
Ещё одним методом, который позволяет разделить белки в зависимости от их молекулярной массы, является гель-электрофорез (см. выше).
Ультрацентрифугирование. Если встряхнуть сосуд, заполненный песком с водой, а затем поставить его на ровную поверхность, то песок быстро осядет на дно благодаря силе земного притяжения. С высокомолекулярными веществами, находящимися в растворе, этого не произойдет, так как тепловое (броуновское) движение сохраняет их равномерное распределение в растворе. Оседание макромолекул, подобно песчинкам, произойдет, только если их подвергнуть значительному ускорению.
 |
В 1923 году шведский биохимик Т. Сведберг впервые использовал ультрацентрифугирование. При скорости вращения ротора 80000 об/мин ему удалось показать, что многие белки состоят из субъединиц. Позже ультрацентрифугирование стало незаменимым методом для разделения белков, нуклеиновых кислот и субклеточных частиц.
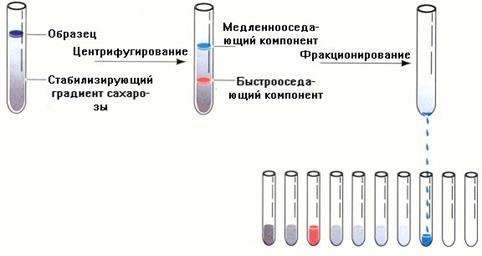
Рис.1.14. Схематическое изображение зонального ультрацентрифугирования.
Образец наслаивают на градиент сахарозы (слева). После центрифугирования (середина) каждая частица осаждается на уровне, зависящем от его массы. После остановки ротора центрифужную пробирку прокалывают и разделенные частицы (зоны) собирают в пробирки (справа).
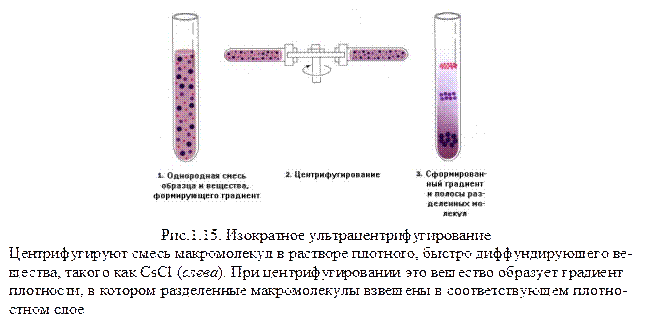
Осаждение проводят в растворе химически инертного вещества (сахарозы или CsCl), концентрация которого и, следовательно, плотность увеличивается в направлении от поверхности до дна центрифужной пробирки. Использование таких градиентов плотности значительно усиливает разрешающую способность ультрацентрифуги. Различают зональное препаративное ультрацентрифугирование (рис.1.14) и ультрацентрифугирование в равновесном градиенте плотности (изократное ультрацентрифугирование) (рис.1.15).
 Разделение белков по разнице биологической активности вследствие связывания с лигандами. Характерной особенностью белков является их способность прочно связываться с различными молекулами, но нековалентными связями. На этом основан метод разделения белков аффинной хроматографией (рис.1.16).
Разделение белков по разнице биологической активности вследствие связывания с лигандами. Характерной особенностью белков является их способность прочно связываться с различными молекулами, но нековалентными связями. На этом основан метод разделения белков аффинной хроматографией (рис.1.16).
Рис.1.16. Схематическое изображение принципа иммуноаффинной хроматографии
Антиген - лиганд для выделяемого белка. Антитело - выделяемый белок.
Молекулы веществ, с которыми специфически связываются определенные белки, ковалентно соединяют с частицами инертного матрикса. Тогда они выполняют роль своеобразных "рыболовных крючков", задерживающих необходимый белок. Все остальные белки транзитом проходят через колонку. Задержанный белок затем можно вымыть из колонки с помощью буферного раствора, содержащего в свободном состоянии такие же молекулы, которые выполняли роль "рыболовных крючков", или с помощью какого-нибудь другого реактива, способного нарушить это взаимодействие. Одним из вариантов этого метода является иммуноаффинная хроматография. Тогда антитела к определенному белку присоединяют к частицам сорбента. Они обеспечивают с очень высокой специфичностью задержку в колонке этого белка (рис.1.16).
Определение аминокислотного состава белка. До определения аминокислотной последовательности выделенного белка желательно иметь представление о его аминокислотном составе, то есть знать, какие аминокислоты и в каком количестве входят в состав его молекулы. Для этого проводят полный гидролиз белка с последующим количественным анализом высвободившихся аминокислот. Чаще используют кислотный гидролиз. Полипептид растворяют в 6N НCl в отсутствие кислорода, чтобы предотвратить окисление серусодержащих аминокислот. Смесь нагревают до 100-1200С и выдерживают при этой температуре в течение 10-100ч. К сожалению при этом способе гидролиза некоторые аминокислоты (Сер, Три, Тир, Глн, Асн) разрушаются.
Аминокислотный состав полипептидного гидролизата определяют с помощью автоматического аминокислотного анализатора. Прибор разделяет аминокислоты посредством ионообменной хроматографии (см. выше). Их идентифицируют по элюционному объему и количественно учитывают по интенсивности флюоресценции после проведения реакции с дансилхлоридом. Современные аминокислотные анализаторы проводят анализ гидролизата белка в течение 1ч с чувствительностью, которая позволяет определить до 1 пикомоля аминокислоты.
Определение N-концевой аминокислоты. Имеется несколько эффективных подходов, с помощью которых можно идентифицировать N-концевую аминокислоту. 1-Диметиламинонафталин-5-сульфонилхлорид (дансил хлорид) взаимодействует с первичными аминами с образованием дансилированного полипептида. Последующее проведение кислотного гидролиза позволяет высвободить из полипептидной цепи N-концевую аминокислоту в виде дансил-аминокислоты, обладающей интенсивной желтой флюоресценцией (рис.1.17).
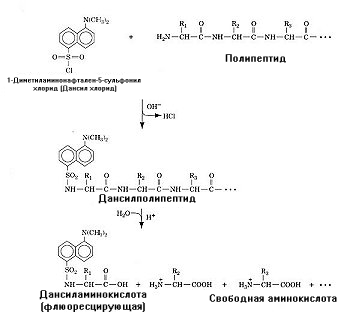
Рис.1.17. Этапы определения N-концевой аминокислоты методом дансилирования
Благодаря этому дансил-производное аминокислоты можно идентифицировать хроматографически.
Ещё более популярным методом идентификации N-концевой аминокислоты является разрушение по Эдману (Pehr Edman - автор метода). Фенилизотиоцианат (ФИТЦ, реактив Эдмана) взаимодействует с N-концевой аминогруппой белков в слабо щелочной среде (рис.1.18). В результате образуется фенилтиокарбамильный продукт. Его обрабатывают безводной сильной кислотой, такой как трифторуксусная кислота. При этом тиазолиновое производное N-концевой аминокислоты отщепляется, в то время как остальные пептидные связи не подвергаются гидролизу. Тем самым разрушение по Эдману заключается в отщеплении остатка только N-концевой аминокислоты и сохранении оставшейся части полипептидной цепи.
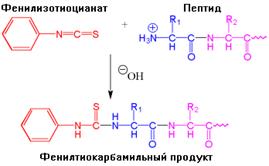 | 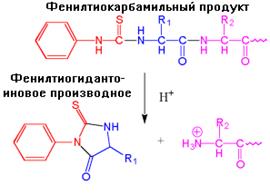 |
| Рис.1.18. Этапы определения N-концевой аминокислоты методом Эдмана |
Тиазолиновое производное аминокислоты избирательно экстрагируют органическим растворителем и превращают в более стабильное фенилтиогидантоиновое производное. Последнее можно идентифицировать сравнением с известными стандартами при проведении тонкослойной хроматографии, электрофореза, высокоэффективной жидкостной хроматографии или газо-жидкостной хроматографии.Наиболее важным преимуществом расщепления по Эдману по сравнению с другими методами определения N-концевой аминокислоты является то, что, проводя повторно с одним и тем же пептидом эту процедуру, каждый раз можно идентифицировать новую N-концевую фенилгидантоин-аминокислоту, выясняя таким образом аминокислотную последовательность.
Идентификация С-концевой аминокислоты. Один из подходов заключается в использовании ферментов - карбоксипептидаз (катализирует отщепление от пептида С-концевой аминокислоты). Карбоксипептидазы, подобно другим ферментам, обладают субстратной специфичностью, то есть они катализируют отщепление определенных аминокислот. Вместе с тем, наличие рядом с С-концевой аминокислотой остатка Про делает невозможной её отщепление под влиянием карбоксипептидазы. В этом случае наиболее надежным считается метод гидразинолиза. Полипептид обрабатывают безводным гидразином при температуре 900С в течение 20-100ч в присутствии ионообменного сорбента (в качестве катализатора). При этом разрушаются все пептидные связи, а из высвобождающихся аминокислот образуются гидразиды. Но С-концевая аминокислота высвобождается как свободная и поэтому её можно идентифицировать хроматографически.
Определение аминокислотной последовательности. Установление концевых аминокислот в исследуемом пептиде позволяет в дальнейшем определить всю его аминокислотную последовательность. Для этого обычно проводят повторное разрушение по Эдману (см. выше) в автоматическом приборе - секвенаторе, который был предложен П. Эдманом и Г. Бэгом. Современный такой прибор определяет 1 аминокислотный остаток в час. Таким способом можно установить последовательность расположения 40-60 остатков аминокислот. Затем накапливаются незавершенные реакции, продукты побочных реакций. Наряду с потерей самого пептида они делают малоинформативной и ненадежной дальнейшую идентификацию аминокислот. Чтобы установить последовательность их расположения в больших полипептидных молекулах, их подвергают расщеплению ферментативным или химическим путем на фрагменты с размерами, достаточными для проведения секвенирования (рис.1.19).
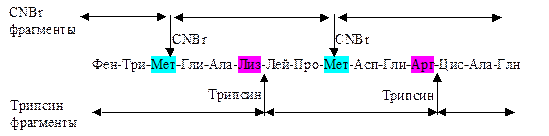
Рис.1.19. Аминокислотную последовательность полипептидной цепи определяют, совмещая перекрывающиеся последовательности фрагментов пептида. В данном случае после расщепления исследуемого пептида трипсином (катализирует разрыв пептидных связей, в образовании которых участвует карбоксильные группы Арг и Лиз), а в другом случае - бромцианом (CNBr) (катализирует разрыв пептидных связей, в образовании которых участвует Мет) были получены два набора пептидных фрагментов. Порядок связывания первых двух фрагментов, образовавшихся в результате действия трипсина, устанавливается на основании того наблюдения, что фрагмент Гли-Ала-Лиз-Лей-Про-Мет (результат расщепления CNBr) имеет последовательность аминокислот на N и С - концах, включающую N и С - концы двух трипсиновых фрагментов. Иными словами, обнаружение накладывающихся участков позволяет установить последовательность расположения пептидных фрагментов, то есть аминокислотную последовательность всего исследуемого пептида.
Исследование последовательности нуклеотидов ДНК - рутинная операция в молекулярной биологии. Этот метод в последнее время вытеснил другие методы исследования первичной структуры белков. Зная последовательность нуклеотидов, можно легко установить последовательность аминокислот (более подробное описание этого метода см. в главе 13).
Метод пептидных карт. Процесс определения аминокислотной последовательности в белке - процедура достаточно длительная. Её можно существенно ускорить в случае выяснения аминокислотной последовательности гомологичного белка[2], если у сравниваемого белка она уже известна. Метод носит название "метод пептидных карт" или "метод отпечатков пальцев". Он включает в себя сочетание хроматографии и электрофореза на бумаге продуктов неполного гидролиза сравниваемых белков. При этом пептидные фрагменты, отличающиеся аминокислотной последовательностью, будут обладать разной подвижностью по сравнению с таковыми у исходного белка (рис.1.21).
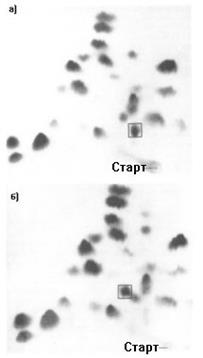 Рис.1.21. Сравнение "отпечатков пальцев" (окраска нингидрином) продуктов расщепления трипсином (а) гемоглобина А и (б) гемоглобина S. Пептиды, отличающиеся по подвижности, обведены квадратом. Они включают в себя 98 аминокислот, расположенных на N-конце b-субъединицы гемоглобина. Различие заключается в замене 6-ой аминокислоты (Глю) в составе Hb A на Вал в составе Hb S.
Рис.1.21. Сравнение "отпечатков пальцев" (окраска нингидрином) продуктов расщепления трипсином (а) гемоглобина А и (б) гемоглобина S. Пептиды, отличающиеся по подвижности, обведены квадратом. Они включают в себя 98 аминокислот, расположенных на N-конце b-субъединицы гемоглобина. Различие заключается в замене 6-ой аминокислоты (Глю) в составе Hb A на Вал в составе Hb S.
 2015-10-16
2015-10-16 11168
11168
