Многие белки в своем составе, помимо аминокислот, могут содержать и небелковые компоненты. Такие небелковые соединения в составе белков получили название простетических групп. В зависимости от химического состава простетической группы сложные белки можно разделить на несколько классов:
1. Хромопротеины. Это белки, простетическая группа которых имеет окраску. К ним относятся многие белки, содержащие металлы. Например, церулоплазмин - белок, содержащий медь, имеет синюю окраску. Белок, переносящий витамин B12, имеет розовый цвет (этот витамин содержит кобальт в своем составе). Хорошо изучены белки, содержащие железо: гемоглобин, миоглобин, цитохромы. Они имеют красную окраску. Присутствие витамина B2 придает белкам желтый цвет (флавопротеины).
2. Гликопротеины. Это белки, простетическая группа которых содержит углеводы. Гликопротеины - это небольшая часть белково-углеводных комплексов, к которым относятся также протеогликаны и мукопротеины. Этим белкам принадлежит важная роль в структурной организации клеток и тканей, они выполняют защитные функции. Основная часть внеклеточных белков - это гликопротеины.
3. Липопротеины. Это белки, простетическая группа которых содержит липиды. Они обеспечивают транспорт липидов в крови, являются компонентами биологических мембран.
4. Металлопротеины. Это белки, частично перекрывающиеся с хромопротеинами. Простетичская группа у них представлена металлами. Они транспортируют или участвуют в депонировании металлов (ферритин, трансферрин).
5. Нуклеопротеины. Простетическая группа у таких белков - нуклеиновая кислота. Различают дезоксирибонуклеопротеины (простетическая группа - ДНК) и рибонуклеопротеины (простетичесая группа - РНК). Им принадлежит важная роль в сохранении, передаче и реализации генетической информации.
6. Фосфопротеины. Белки, которые содержат в своем составе фосфорную кислоту, популярны в клетке потому, что процесс фосфорилирования является способом влияния на конформацию белка и поэтому используется в системах регуляции процессов жизнедеятельности.
Простетические группы соединяются разными типами связей. Так для нуклеопротеинов характерной является ионная связь, у гликопротеинов и фосфопротеинов преобладает ковалентная связь, у липопротеинов - силы гидрофобного взаимодействия, металлопротеинов - донорно-акцепторные связи.
В качестве примера особенности роли структуры в биологических функциях можно привести данные по двум белкам - миоглобине и гемоглобине. Они имеют некоторое структурное и функциональное сходство. Миоглобин и гемоглобин обладают простетичесой групой - гемом. Он, по химической структуре, является циклическим тетрапирролом и придает белкам красный цвет (рис.1.33). Тетрапирол состоит из 4-х пиррольных колец, соединенных в плоскую молекулу метиленовыми мостиками. Атом железа занимает центральное положение
 | 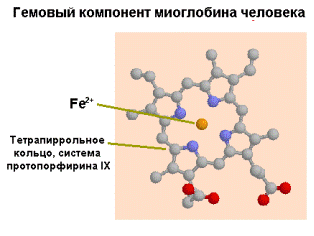 |
| Рис.1.33. Пространственное строение миоглобина человека |
в этой плоской молекуле. Существуют и другие белки с тетрапиррольными структурами (цитохромы, каталаза и т.д). Железо в составе гема цитохромов способно менять свою валентность. Напротив, в гемоглобине и миоглобине изменение валентности нарушает их функцию. Главная функция этих белков - связывание кислорода.
Миоглобин - это сферическая молекула 4.5х3.5х2.5 нм, состоит из 153 аминокислот с общей молекулярной массой 17000. На уровне вторичной структуры он образует 8 a-спиральных участков, захватывающих почти 75% всех аминокислот молекулы. Атом железа в геме миоглобина, не связанном с кислородом, выступает из плоскости молекулы на 0.03 нм. В оксигенированной форме атом железа как бы погружается в плоскость молекулы гема.
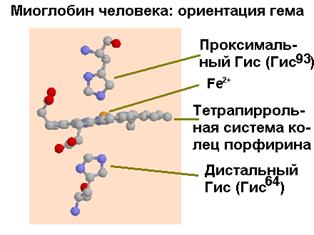 | 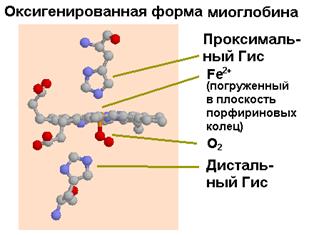 |
| Рис.1.34. Изменение ориентации гема в результате связывания кислорода (слева - дезоксигенированное состояние) |
Образуя связь с одной из молекул гистидина глобиновой части, железо при соединении с кислородом изменяет и конформацию белковой части. Чем можно объяснить тот факт, что миоглобин удобен для хранения кислорода, но не удобен для транспорта его по крови? Ответ на этот вопрос можно получить, если познакомиться с графическим выражением процесса насыщения миоглобина и гемоглобина кислородом в зависимости от парциального давления кислорода.
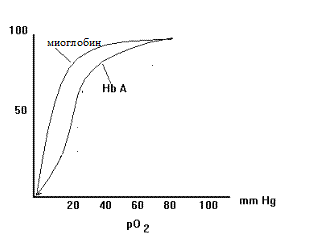 | 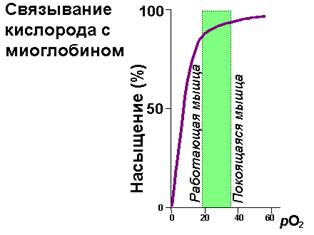 |
| Рис. 1.35. Различия в насыщении кислородом миоглобина и гемоглобина в зависимости от его парциального давления |
Кривая насыщения миоглобина кислородом представлена гиперболой (рис.1.35). В сосудах легких, где парциальное давление кислорода 100 мм Hg, миоглобин бы хорошо насыщался кислородом. Однако в венозной крови это давление составляет 40 мм Hg а в мыщцах - 20. В таких условиях миоглобин отдает довольно мало кислорода, поэтому он был бы недостаточно эффективен в транспорте кислорода от легких к тканям. Эту функцию успешно осуществляет гемоглобин.
В отличие от миоглобина гемоглобин - это белок с четвертичной структурой. Он состоит из 4-х попарно одинаковых полипептидных цепей. Эти цепи обозначаются буквами греческого алфавита a -, b -, g - и т. д. Тетрамеры пептидных цепей формируют молекулы,
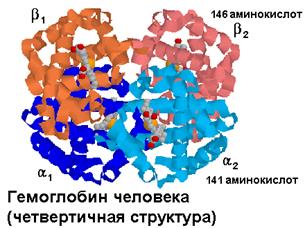
обозначаемые буквами латинского алфавита. Основной гемоглобин взрослого здорового человека обозначается Hb A и состоит из двух a (141 аминокислота) и двух b (146 аминокислот) цепей.
Гемоглобин связывает 4 молекулы кислорода. Кривая насыщения гемоглобина кислородом в отличие от миоглобина имеет S-образный характер (рис.1.35, слева). Такой тип кривой показыает, что присоединение одной молекулы кислорода ускоряет присоединение последующих, что свидетельствует о кинетике кооперативного связывания. Сравнение зависимости насыщения от парциального давления кислорода показывает, что при парциальных давлениях кислорода, характерных для тканей, гемоглобин отдает значительные количества кислорода. Это позволяет придти к заключению о том, что гемоглобин - хорошее транспортное средство для переноса кислорода и обеспечении им тканей.
Подобно изменениям, отмеченным выше при описании механизма насыщения кислородом миоглобина, в гемоглобине также происходит перемещение атома железа в плоскость гема с одновременным изменением конформации полипептидной цепи. Однако гемоглобин - белок с четвертичной структурой, и отдельные его цепи связаны между собой. В результате изменения конформации передаются на область связи между полипептидными цепями, а это, в свою очередь, изменяет положение в пространстве всей молекулы и облегчает доступ кислорода к остальным гемам молекулы гемоглобина. Одновременно это изменение
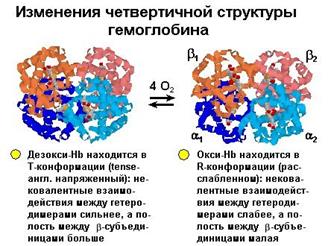
Рис.1.36. Изменения конформации гемоглобина в результате связывания с кислородом
конформации сопровождается появлением на поверхности групп, которые, диссоциируя, отдают протоны в окружающую среду.
При понижении парциального давления кислорода события повторяются, но уже в обратном направлении: отдача кислорода идет по мере снижения парциального давления, гемоглобин переходит в другое конформационное состояние, при этом из окружающей среды (ткани), где высока концентрация протонов, последние присоединяются к гемоглобину.
Такие изменения конформации позволяют гемоглобину не только регулировать обеспечение кислородом тканей (подробней см. главу "Ферменты"), но и участвовать в поддержании кислотно-щелочного равновесия в организме.
Типы гемоглобинов человека. Ниже представлены основные типы гемоглобина, которые встречаются у человека в различные периоды его развития.
Таблица 1.2.
Структурные признаки гемоглобинов человека
| Белок | Состав глобиновой цепи | Распространение |
| Гемоглобин А (Hb A) | a2b2 | Основной тип гемоглобина у взрослых (95-98%) |
| Гемоглобин А2 (Hb A2) | a2d2 | Минорный тип гемоглобина у взрослых (1,5-3,5%) |
| Гемоглобин F (Hb F) | a2g2 | Основной тип гемоглобина у плода; у взрослых - 0,5-1% |
| Hb Гувер-1 | z2e2 | Эмбриональный гемоглобин |
| Hb Гувер-2 | a2e2 | Эмбриональный гемоглобин |
| Hb Портланд | z2g2 | Эмбриональный гемоглобин |
Во время внутриутробного развития плод получает кислород из крови матери через плаценту. Для обеспечения бесперебойного поступления кислорода таким путем кровь плода должна иметь большее сродство к кислороду, чем кровь матери. За счет чего это достигается?
У плода образуется Hb F, молекула которого также состоит из четырех субъединиц, двух - a и двух - g. Наиболее значительным отличием g-глобиновой субъединицы от b-глобиновой субъединицы является замещение остатка полярной заряженной аминокислоты Гис143 в b-субъединице незаряженной аминокислотой Сер в g-субъединице. Это приводит к тому, что Hb F имеет более низкое сродство для аллостерического регулятора 2,3-бис-фосфоглицерата (см. главу "Обмен углеводов"), чем Hb A. Тем самым он обладает гораздо большим сродством к кислороду.
С другой стороны, изменения аминокислотного состава глобиновых субъединиц, возникающие в результате мутаций соответствующих генов, приводят к образованию патологических форм гемоглобина и развитию заболеваний - гемоглобинопатий.
Таблица 1.3.
Виды гемоглобинопатий
| Эффект | Гемоглобин | Мутация | Последствия |
| Сниженное сродство к кислороду | Hb Канзас | Асн102b®Тре | Небольшой цианоз |
| Увеличенное сродство к кислороду | Hb Шеферда - Буша | Гли74b®Асп | Сниженное связывание бис-фосфоглице-рата; полицитемия |
| Окисленный гем | Hb М | Гис87a®Тир | Метгемоглобин; цианоз |
| Потеря (в результате нарушения связывания) гема | Hb Хаммерсмита | Фен42b®Сер | Нестабильная b-субъединица |
| Серповидные клетки | Hb S | Глю6b®Вал | Гемолитическая анемия |
| Диссоциация на димеры | Hb Бибба | Лей136a®Про | Нестабильный тетрамер |
| Нарушенный синтез | Hb Агнана | Вставка ТГ в 94 кодоне - образование b-субъединицы со 156 аминокислотами | Доминантная талассемия, анемия |
Талассемические синдромы развиваются вследствие нефункционирующих глобиновых генов. При этом недостаточный синтез любой из субъединиц гемоглобина приводит к гемолитической анемии. Тяжесть этого состояния зависит от количества генов в аллельной паре, подвергшихся мутации. Различают b-талассемию, при которой снижен уровень b-глобина. В этом случае в качестве компенсаторной реакции в организме продолжается образование Hb F (a2g2). a-талассемия характеризуется сниженным уровнем образования a-глобина. Обычно это более тяжелое состояние, чем b-талассемия. Клинически проявления могут варьировать от средней и тяжелой анемии до мертворождения. Компенсаторно при a-талассемии образуется Hb H (b4) и гемоглобин Барта (g4). Надо отметить, что ни один из этих гемоглобинов не подвержен аллостерической регуляции и эффекту Бора; они оба остаются в R-конформационном состоянии (рис.1.36).
Серповидно-клеточная анемия возникает в результате точечной мутации гена b-глобина, которая приводит при его экспрессии к замене в шестом положении b-глобиновой полипептидной цепи Глю на Вал. Следовательно, у индивидуумов с HbS заменена полярная группа боковых цепей на внешней поверхности молекулы неполярной гидрофобной группой боковых цепей (неконсервативная мутация). За счет гидрофобного взаимодействия между этими неполярными радикалами валина HbS в его дезоксиконформации полимеризуется с другими молекулами дезокси HbS, приводя к осаждению гемоглобина в эритроцитах. Осаждение гемоглобина придает эритроциту форму серпа и неустойчивость, что приводит к ускорению гемолиза и изменению эластических свойств мембраны, необходимых во время кровообращения через маленькие капилляры. Такие эритроциты вызывают закупоривание капилляров.
Серповидно-клеточная анемия является наследуемым мультисистемным заболеванием, для которого характерны как физиологические, так и психосоциальные проявления. Различают три генотипа с различной клинической картиной проявления этого расстройства:
- У гомозигот (Hb SS) - тяжелая серповидно-клеточная анемия
- У гетерозигот (Hb AS) - слабо выражена клиническая симптоматика
- Смешаная форма серповидно-клеточного заболевания и b4-талассемии. При ней наследуются два патологических типа гемоглобина. Для неё характерна благоприятная клиническая симптоматика. Гематологически тяжесть его обратно пропорциональна количеству Hb А. Последнее может колебаться от 3 до 25%.
Основные симптомами этого заболевания являются гемолитическая анемия и периодически проявляющийся болевой синдром. Интересно, что индивидуумы, гетерозиготные по HbS, устойчивы к паразиту малярии, который проводит часть своего жизненного цикла в эритроцитах. Это является фактором отбора гена HbS в малярийных регионах мира.
HbS открывается гель электрофорезом. Отсутствие Глу делает его менее кислым, чем гемоглобин А, поэтому он мигрирует не так быстро при электрофорезе. Возможна диагностика и генрекомбинантым методом.
 2015-10-16
2015-10-16 2943
2943
