А. Реакции первого порядка. Рассмотрим самую простую реакцию необратимого превращения S à P. Однонаправленная стрелка указывает на то, что обратная реакция протекает очень медленно и равновесие сдвинуто вправо. Скорость такой реакции - это скорость образования продукта
V = d[P] /dt
Единица скорости такой реакции - моль/л/с, если P - молярная концентрация вещества P.
Образование P будет сопровождаться снижением количества S, и следовательно, скорость можно определить по уменьшению количества S:
V = -d [S] /dt
Превращение каждой молекулы S в P - независимое событие. Поэтому по мере снижения концентрации S будет снижаться и скорость реакции, т.е. скорость реакции будет пропорциональна концентрации S. Суммируя, можно утверждать, что
V = d [P] /dT = -d [S] /dT = k1 [S]
В этом уравнении k1 - это константа скорости реакции. Единица измерения константы скорости приведенной реакции секунда-1. В уравнении скорости большая информация содержится в показателе степени при концентрациях реагирующих веществ. В приведенных примерах этот показатель равен единице, это означает, что ее скорость в первую очередь зависит от концентрации субстрата. Если значение k1 большое, реакция протекает быстро, а если - маленькое, реакция протекает медленно. Реакции такого типа называют реакциями первого порядка. График этого уравнения (Рис 2-2) показывает, что концентрация снижается по
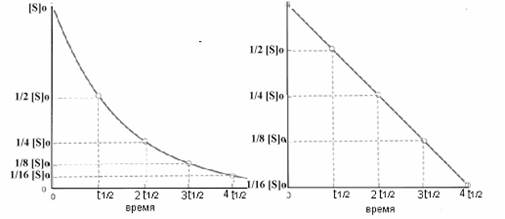
Рис 2-2. Изменение концентрации реагирующего вещества во времени. Справа изменения концентрации выражены в логарифмической шкале
экспоненте во времени. Количество времени, необходимого для уменьшения концентрации S в 2 раза, называется периодом полураспада и обозначается t1/2. Период полураспада обратно пропорционален k1.
График ln[S] против t, как показано на Рис 2-2 справа, будет всегда прямой линией с наклоном = -k1, если это реакция первого порядка.
Наиболее широко приводимый пример реакции первого порядка - распад радиоактивных элементов.
Описанный выше подход нельзя полностью применить к реакциям, протекающим в биологических системах, где многие реакции и процессы являются обратимыми. Это означает, что по мере накопления продукта приобретает значение обратная реакция. Например, в реакции S < = > P, константа прямой реакции, k1 определяет реакцию, идущую вправо, а константа обратной реакции, k -1 определяет реакцию, идущую влево.
Поскольку молекула S используется в реакции идущей вправо и образуется в реакции идущей влево, то соответствующее уравнение скорости
-V = d[S]/dt = -k1[S] + k-1[P]
Здесь, k1 и k-1 - константы скорости для прямой и обратной реакций первого порядка. Такая реакция постепенно приближается к состоянию равновесия, при котором скорости прямой и обратной реакции становятся равными, а скорость суммарной реакции становится равной нулю
0 = -k1[S]равн + k-1[P]равн или
[P]равн/[S]равн = k1/k-1 = K
где K - константа равновесия. Для обратимой реакции, которая является реакцией первого порядка в обоих направлениях, константа равновесия - всегда отношение констант прямой и обратной реакции.
Б. Реакции второго порядка. Реакции первого порядка описывают изменения индивидуальных молекул. Но многие биохимические реакции включают взаимодействия между несколькими молекулами
Реакции второго порядка характерны для взаимодействия двух молекул, которое заканчивается образованием одного продукта. Простейший пример
S+S à S2
Скорость такой реакции пропорциональна квадрату концентрации реагирующих молекул. Поэтому
V = -d[S]/dt = -k2[S]2
Здесь k2 константа скорости реакции второго порядка. Она имеет размерность (моль/л)-1s-1.
В случае, если один из участников реакции присутствует в избытке и изменения его в ходе реакции незначительны (например, реакции гидролиза) выделяют реакции псевдо первого порядка.
Порядок данной реакции можно определить, если построить график зависимости начальной скорости реакции от различных стартовых концентраций ([S]0). На рис 2-3 представлены такие графики для реакций нулевого, первого и второго порядков.
Еще более сложный род реакций включает комплексные многоступенчатые процессы. Мы не затрагиваем их кинетику, хотя мы потом увидим, что реакции, катализируемые ферментами, если их анализировать в деталях, в целом более сложны, чем описанные выше. Довольно часто анализ схем многоступенчатых процессов позволяет упростить их введением понятия «ключевая реакция». В ряде случаев скорость реакции не зависит от текущей концентрации реагента. Тогда говорят о нулевой степени этой концентрации, данную реакцию относят к реакциям нулевого порядка
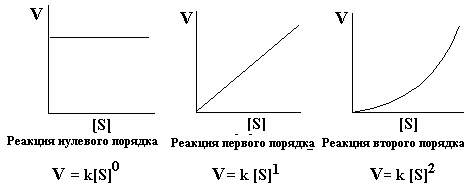
Рис 2-3. График зависимости начальной скорости реакции от различных стартовых концентраций ([S]0).
.
 2015-10-16
2015-10-16 2470
2470
