Математическое моделирование кинетики цепного окисления
Совокупность химических уравнений кинетики цепного окисления липидов выглядит солидно:
HO· + LH -> HOH + L· (1)
L· + O2 -> LO2· (2)
LO2· + LH -> LOOH + L· (3)
L· + L· -> LL (4)
L· + LO2· -> LOOL (5)
LO2· + LO2· -> L=O + LOH + фотон (6)
L· + InH -> LH + In· (7)
In· + In· -> In-In (8)
Fe2+ + L· + H+ -> Fe3+ + LH (9)
LO· + LH -> LOH + L· (9а)
Fe2+ + LOOH -> Fe3+ + LO· + OH- (10)
Fe2+ + LO2· + H+ -> Fe3+ + LOOH (11)
Система дифференциальных уравнений, описывающих процесс, будет очень сложной, а константы скоростей большинства перечисленных реакций неизвестны. Можно однако существенно упростить систему химических, а значит - и дифференциальных уравнений кинетики, если использовать два важных закона химической кинетики:
Правило 1: Скорость нескольких последовательных реакций равна скорости самой медленной из них.
Это правило позволяет заменить последовательные реакции одной обобщённой реакцией, приняв константу скорости этой реакции равной константе скорости самой медленной из последовательных реакций. В нашем случае реакции 2 и 3 - это последовательные реакции. Для наших целей не очень важно, какую из них считать более медленной. В кислородсодержащей среде скорость реакции 3 во много раз ниже скорости реакции 2, поэтому уравнение реакции продолжения цепи можно записать так:
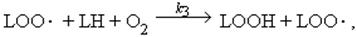
а константа скорости этой реакции будет равна константе скорости реакции 3, которую мы обозначим как k3; константы скоростей мы в дальнейшем будем писать над стрелкой в химическом уравнении реакции.
Правило 2: Из нескольких параллельных реакций наибольшую роль играет самая быстрая; для простоты, остальными реакциями иногда можно пренебречь.
Это правило позволяет заметно упростить приведенную выше схему из одиннадцати реакций.
- В присутствии кислорода воздуха радикалов LO· и L· гораздо меньше, чем радикалов LOO·; поэтому реакциями 4 и 5 можно пренебречь оставив только одну реакцию взаимодействия радикалов - реакцию 6.
- При наличии в среде ионов Fe2+ и при незначительной концентрации других антиоксидантов часто можно пренебречь реакцией 7, оставив реакцию 9. Реакцию 9а мы тоже не будем пока принимать во внимание.
- В отсутствие иных источников свободных радикалов, образование новых радикалов происходит только в реакции 10 (реакция разветвления цепей). Обозначим константу скорости этой реакции как kp. Реакцией 1 можно пренебречь, если нет источника радикалов HO·.
После всех этих упрощений получаем систему химических уравнений цепного окисления липидов, содержащую всего четыре реакции:
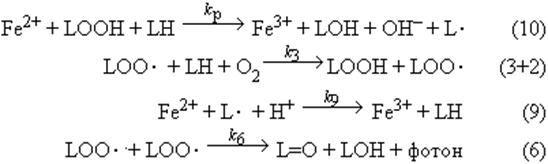
 2014-02-03
2014-02-03 425
425








