В отличие от простых (одностадийных) реакций, механизм которых совпадает со стехиометрическим уравнением реакции, подавляющее большинство химических реакций является сложными, т.е. протекает через ряд последовательных и (или) параллельных стадий, при этом некоторые стадии протекают с участием промежуточных веществ, не являющихся ни исходными веществами, ни продуктами реакции. То есть в случае сложных реакций в системе протекают две или большее количество реакций.
В основе описание кинетики сложных реакций лежат: а) принцип независимости протекания реакций, б) принцип лимитирующей стадии.
Согласно принципу независимости протекания реакций “если в системе одновременно протекает несколько реакций, то каждая из них независима от остальных и скорость ее прямо пропорциональна произведению концентраций реагирующих веществ”.
Однако принцип независимости протекания реакций не является таким же общим положением как основной постулат химической кинетики. Он не применим, например, к сопряженным реакциям.
Рассмотрим некоторые сложные реакции.
Обратимые реакции.
Обратимыми называются реакции, в которых наряду с превращением исходных веществ в продукты протекает с заметной скоростью и противоположно направленная реакция превращения продуктов в исходные вещества.
В системах, в которых протекают такие реакции, через некоторое время достигается состояние химического равновесия.
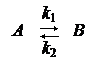 |
Обратимые реакции – это реакции типа:
Простейший случай - это реакция первого порядка.
Реакция идет до установления равновесия, при котором
w прямой = w обр., т.е. k 1 CA = k 2 CB
В состоянии равновесия
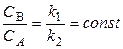 = k равн.
= k равн.
Поскольку вещество А расходуется в прямой реакции и образуется в обратной, то суммарная скорость по изменению концентрации вещества А со временем описывается следующим уравнением
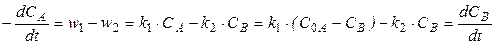 , (16)
, (16)
где w 1 и w 2 - скорости прямой и обратной реакций, соответственно;
С 0 А - начальная концентрация вещества А (начальная концентрация вещества В принята равной нулю);
СА и СВ - текущие концентрации веществ А и В в момент времени t (рис. 6).
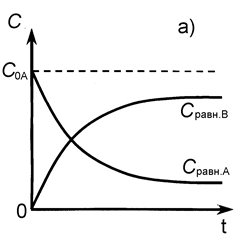
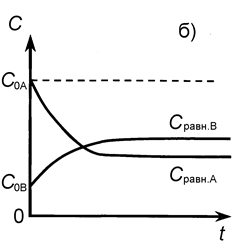
Рис. 6. Кинетические кривые для обратимой реакции
а) С 0В = 0, б) С 0В ¹ 0.
Параллельные реакции.
Параллельными называют реакции, в которых одни и те же исходные вещества реагируют одновременно в двух или более направлениях.
В простейшем случае это реакции типа
В 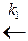 А
А 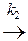 С.
С.
Обе реакции являются необратимыми реакциями первого порядка. Суммарная скорость расходования вещества А равна
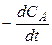 = w 1 + w 2 = k 1 CA + k 2 CA = (k 1 + k 2) CA, (17)
= w 1 + w 2 = k 1 CA + k 2 CA = (k 1 + k 2) CA, (17)
где w 1 и w 2 - скорости превращения вещества А в вещества В и С, соответственно.
После интегрирования уравнения (17) получаем
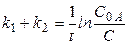 . (18)
. (18)
По уравнению (18) можно рассчитать сумму констант (k 1 + k 2). Чтобы разделить эту сумму на отдельные составляющие, необходимо использовать еще одно уравнение, дающее отношение констант в некоторый момент времени t. Очевидно, что в любой момент времени
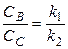 , (19)
, (19)
где CB и CC - текущие концентрации веществ В и С. Решая систему уравнений (18) и (19), можно найти значения констант скорости по отдельности.
Кинетические кривые для рассматриваемого случая показаны на рис. 7.
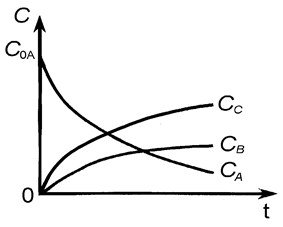
Рис. 7.
Последовательные реакции.
К последовательным реакциям относят реакции типа:
А  В
В 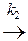 С.
С.
Вещество В образуется из А (константа k 1) и расходуется на образование С (константа k 2), обе реакции являются необратимыми реакциями первого порядка.
Рассматриваемая реакция является двухстадийной с образованием промежуточного соединения.
Скорость первой стадии w1 = k1CA, скорость второй стадии w2 = k2CB.
Скорость реакции можно выразить через изменение концентраций всех участников реакции:
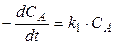
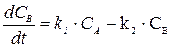
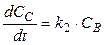
Кинетические кривые для рассматриваемого случая показаны на рис. 8.
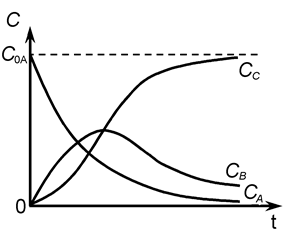
Рис. 8.
Скорость всего процесса будет определяться лимитирующей стадией сложной реакции. Положение максимума на кривой «CB» (и точки перегиба на кривой «CC») определяются соотношением величин k 1 и k 2.
а) если k 1 >> k 2, промежуточный продукт B будет устойчив и может быть достигнута концентрация CB, соизмеримая с CA; продукт С образуется с малой скоростью.
б) если k 2 >> k 1, промежуточный продукт B - неустойчив, его концентрация CB - мала, но высока скорость образования продукта С.
Понятие о лимитирующей стадии.
Нередко скорость сложной химической реакции может зависеть только от скорости одной из ее стадий. Эту стадию называют лимитирующей (т. е. определяющей скорость всей реакции в целом).
Принцип лимитирующей стадии - скорость последовательной реакции определяется скоростью наиболее медленной стадии, суммарная скорость параллельных реакций определяется скоростью наиболее быстрой стадии.
 2014-02-02
2014-02-02 12589
12589
