Количественные методы определения белка можно разделить на турбидиметрические и колориметрические.
Турбидиметрические методы
К турбидиметрическим методам относятся:
определение белка с сульфосалициловой кислотой (ССК),
определение белка с трихлоруксусной кислотой (ТХУ),
определение белка с бензетоний хлоридом.
Турбидиметрические методы основаны на снижении растворимости белков вследствие образования суспензии взвешенных частиц под воздействием преципитирующих агентов. О содержании белка в исследуемой пробе судят либо по интенсивности светорассеяния, определяемого числом светорассеивающих частиц (нефелометрический метод анализа), либо по ослаблению светового потока образовавшейся суспензией (турбидиметрический метод анализа).
Величина светорассеяния в преципитационных методах обнаружения белка зависит от множества факторов: скорости смешивания реактивов, температуры реакционной смеси, значения pH среды, присутствия посторонних соединений, способов фотометрии. Тщательное соблюдение условий реакции способствует образованию стабильной суспензии с постоянным размером взвешенных частиц и получению относительно воспроизводимых результатов.
Турбидиметрические методы плохо поддаются стандартизации, часто приводят к получению ошибочных результатов, но, несмотря на это, в настоящее время они широко используются в лабораториях из-за невысокой стоимости и доступности реактивов. Наиболее широко в России используется метод определения белка с сульфосалициловой кислотой.
Колориметрические методы
Наиболее чувствительными и точными являются колориметрические методы определения общего белка, основанные на специфических цветных реакциях белков.
К ним относятся:
1) Биуретовая реакция.
Принцип метода. Метод основан на способности белков давать с раствором сернокислой меди фиолетовое окрашивание в щелочной среде. Для биуретовой реакции необходимо наличие двух ОН-групп и трех атомов азота, находящихся в полипептидной цепи. Группа, образующая пептидную связь (– ОС – NH –) в щелочной среде, присутствует в своей таутомерной форме. В избытке щелочи происходит диссоциация водорода енольной ОН-группы, при этом возникает отрицательный заряд, с помощью которого кислород, взаимодействуя с медью, образует соль; кроме того, медь образует дополнительные (дативные) связи с атомами азота пептидных связей. Возникший комплекс характеризуется высокой стабильностью.
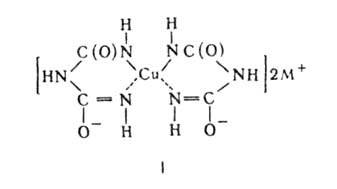 где М+ - катион щелочного металла
где М+ - катион щелочного металла
В реакцию, подобную биуретовой, вступают многие вещества, содержащие в молекуле не менее двух амидных группировок, аминогидроксиэтиленовую группу —CH(NH2)CH(OH)—, амиды и имиды аминокислот и некоторые другие соединения.
Биуретовую реакцию нельзя проводить в присутствии солей аммония из-за образования медно - аммиачных комплексов.
Чувствительность метода. С помощью биуретовой реакции можно количественно определить от 20 до 400 мкг белкового азота.
Реактивы
1) Натр едкий, ч. д. а. или х. ч., 0,2 моль/л: 8 г едкого натра помещают в мерную колбу вместимостью 1 л, осторожно растворяют в воде и доводят до метки водой.
2) Биуретовый реактив в 1 л раствора содержит виннокислый калий-натрий (NаКС4Н4О6•4Н2О) 9,0 г; CuS04 * 5Н20 3,0 г; KI 5,0 г; 0,2 н. NaOH (свободный от карбонатов).
Виннокислый калий-натрий растворяют в 400 мл 0,2 м. NaOH и прибавляют сульфат меди. Когда компоненты растворятся, добавляют йодистый калий, а затем доводят объем раствора до 1000 мл 0,2 м. NaOH. Реактив хранят в темном месте в парафинированной или полиэтиленовой склянке не более 2 недель.
!Биуретовый реактив содержит едкое вещество - гидроксид натрия и вредное вещество - сульфат меди. При попадании реактива на кожу и слизистые промыть их большим количеством проточной воды.!
3) Калибровочный раствор альбумина (из бычьей сыворотки) - 10 г/л раствор альбумина: 0,1 г альбумина из бычьей сыворотки растворяют в 6 — 7 мл дистиллированной воды и доводят до объема 10 мл; 1 мл стандартного раствора содержит 0,01 г белка (10мг/мл).
Калибровочный график строят в пределах концентраций от 1 до 10
мг стандартного образца белка.
| Приготовление разведений для построения калибровочного графика | |||
| № про бирки | Стандартный раствор, мл | дистиллированная вода | Концентрация белка мг/мл |
| - |
Ход работы.
Для построения калибровочного графика из стандартного раствора альбумина готовят растворы белка, содержащие 2, 4, 6, 8 и 10 мг альбумина в 1 мл. В две пробирки, содержащие по 1 мл раствора белка соответствующего разведения добавляют по 4 мл биуретового реактива, перемешивают, избегая образования пены, и оставляют при комнатной температуре на 30 мин. Не позднее чем через час измеряют оптическую плотность раствора на ФЭК при 540 нм (зеленый светофильтр)в 1 см кювете. Измерение проводят против холостой пробы.
Холостая проба. 1 мл дистиллированной воды смешивают с 4 мл биуретового реактива.
На каждую точку проводят два определения, для построения калибровочного графика используют среднее арифметическое.
Содержание белка в исследуемых растворах рассчитывают по калибровочному графику.
Для этого к 1 мл исследуемого раствора добавляют 4 мл биуретового реактива, перемешивают, избегая образования пены, и оставляют при комнатной температуре на 30 мин. Не позднее чем через час измеряют оптическую плотность раствора на ФЭК при 540 нм (зеленый светофильтр)в 1 см кювете. Измерение проводят против холостой пробы.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ БЕЛКА С ПОМОЩЬЮ ФЕНОЛЬНОГО РЕАКТИВА ФОЛИНА—ЧИОКАЛЬТЕУ.
Принцип метода. Фенольный реактив Фолина—Чиокальтеу дает синее окрашивание с щелочными растворами белков. Интенсивность окрашивания в основном зависит от содержания в исследуемом белке тирозина и триптофана. Реакцию применяют для определения аминокислот в биол. р-рах, напр. крови. Реакция неспецифична, т.к. большинство др. первичных аминов дает окраску в тех же условиях. Чувствительность метода. С помощью макрометода можно определить 100—500, а микрометода — 5—35 мкг белкового азота.
МАКРОМЕТОД
Реактивы.
1) Реактив Фолина, к-рый представляет собой водный р-р H7[P(W2O7)] и (иногда) Н7[Р(Мо2О7)6]. Собственно реактив Фолина готовят след. образом: 100 г вольфрамата Na, 150 мл H2O и 33 мл 85%-ной H3PO4 кипятят с обратным холодильником в течение часа; добавляют 0,2-0,25 мл Br2 и кипятят до удаления паров последнего, затем разбавляют водой до 1 л. Этот реактив предложил в 1912 О. Фолин для определения фенолов.
Часто под реактивом Фолина подразумевают реактив Фо-лина-Чиокалтеу, к-рый готовят неск. иначе: 100 г вольфрамата Na, 25 мг молибдата Na, 700 мл H2O, 50 мл 85%-ной H3PO4 и 100 мл HCl кипятят с обратным холодильником 10 ч, затем добавляют 150 г сульфата Li, 50 мл H2O и 3-4 капли Br2, избыток к-рого удаляют кипячением в течение ок. 15 мин; смесь охлаждают, разбавляют водой до 1 л и фильтруют. Используют и др. модификации реактива Фолина.
Взаимодействие Na-соли 3,4-нафтохинон-1-сульфокис-лоты (ф-ла I) с аминокислотами в слабощелочной среде с образованием хиноидного соед. коричнево-красного цвета с максимумом поглощения при 500-540 нм:
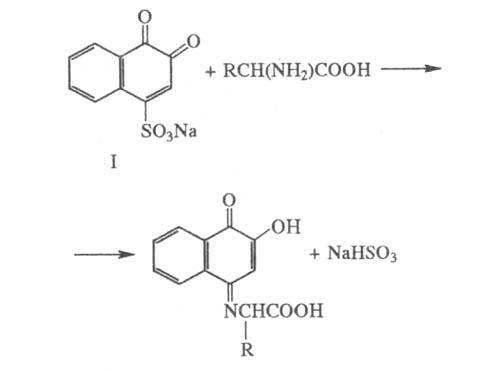
2) 20%-ный раствор Na2C03.
Методика.
9 мл исследуемого раствора вносят пипеткой в центрифужную пробирку или коническую колбу на 50 мл и медленно при постоянном помешивании добавляют к нему 5 мл 20%-ного раствора Na2C03. После этого, осторожно перемешивая, по каплям вливают 1 мл реактива Фолина—Чиокальтеу. Пробу на 5 мин погружают в водяную баню при 37° С, затем на 30 мин оставляют при комнатной температуре и определяют оптическую плотность при 750 нм.
Контрольная проба: к 9 мл дистиллированной воды добавляют 5 мл 20%-ного раствора Na2C03 и 1 мл реактива Фолина.
Примечания. 1. Интенсивность цветной реакции с разными белками может быть различной, поэтому при постановке как макро-, так и микрометода для каждого исследуемого белка рекомендуется построить калибровочную кривую.
2. Цветная реакция зависит не только от содержания тирозина и триптофана в данном белке, но и от присутствия SH- и других восстанавливающих групп, а также от времени, в течение которого белок содержался в щелочной среде до прибавления реактива Фолина—Чиокальтеу.
3. Определение белка по Фолину—Чиокальтеу проводится довольно быстро и не требует предварительного разрушения исследуемого материала, поэтому оно, несомненно, удобно. Однако если требуется выразить результаты в единицах белкового азота, то следует построить калибровочную кривую на основе количественного определения белкового азота по Кьельдалю.
2 ) Метод Лоури.
Метод количественного определения белка, основанный на измерении концентрации окрашенных продуктов, образующихся в результате сочетания двух химических реакций: биуретовой реакции на пептидную связь и взаимодействия реактива Фолина — Чокалтеу с ароматическими аминокислотами. Предложен Лоури (Lowry) в 1951 году.
Принцип
В щелочной среде ионы Cu+2 образуют комплекс с пептидными связями, переходя в Cu+. Одновалентные ионы меди реагируют с реактивом Фолина (фосфомолибденовая кислота с фенолом), образуя нестабильный продукт, переходящий в молибденовую синь, с максимумом адсорбции при 750 нм. Увеличение адсорбции при 750 нм пропорционально концентрации белка. Метод очень чувствителен к наличию в растворе посторонних восстановителей (что затрудняет его использование при определении белка в неочищенных препаратах), чувствительность к белку - 10 - 100 мкг/мл.
1 мл раствора препарата, содержащего 0,025-0,250 мг испытуемого белка, помещают в пробирку, прибавляют 2 мл Биуретового реактива и оставляют при комнатной температуре на 10 мин. Затем прибавляют 0,5 мл реактива Фолина, перемешивают и через 30-40 мин измеряют оптическую плотность на спектрофотометре при длине волны 750 нм в кювете с толщиной слоя 10 мм. В качестве раствора сравнения используют смесь этих же реактивов без препарата.
Калибровочный график строят в пределах концентраций от 0,025 до 0,250 мг стандартного образца белка, измеряя оптическую плотность растворов при 750 нм.
3) Методы, основанные на способности различных красителей образовывать комплексы с белками:
-Понсо S (Ponceau S),
-Кумасси бриллиантовый синий (Coomassie Brilliant Blue)
-пирогаллоловый красный (Pyrogallol Red).
Достаточная чувствительность, хорошая воспроизводимость и простота определения белка по связыванию красителей делают эти методы перспективными, однако высокая стоимость реактивов препятствует более широкому их использованию в лабораториях. В настоящее время в России все большее распространение получает метод с пирогаллоловым красным.
С точки зрения исполнителя, в повседневной работе лаборатории при большом потоке исследований биуретовый метод является неудобным из-за большого числа операций. В то же время, метод характеризуется высокой аналитической надежностью, позволяет определять белок в широком диапазоне концентраций и выявлять альбумин, глобулины и парапротеины со сравнимой чувствительностью, вследствие чего биуретовый метод рассматривают в качестве референтного и рекомендуют для сравнения других аналитических методов обнаружения белка в моче. Биуретовый метод определения белка предпочтительно выполнять в тех случаях, когда результаты определения с помощью других методов представляются сомнительными.
Метод Лоури, обладающий более высокой чувствительностью по сравнению с биуретовым методом, сочетает биуретовую реакцию и реакцию Фолина на аминокислоты тирозин и триптофан в составе белковой молекулы. Несмотря на высокую чувствительность, данный метод не всегда обеспечивает получение надежных результатов при определении содержания белка в моче. Причиной тому служит неспецифическое взаимодействие реактива Фолина с небелковыми компонентами мочи (чаще всего аминокислотами, мочевой кислотой, углеводами). Отделение этих и других компонентов мочи путем диализа или осаждения белков позволяет с успехом использовать данный метод для количественного определения белка в моче. Некоторые лекарственные препараты – салицилаты, хлорпромазин, тетрациклины способны оказывать влияние на данный метод и извращать результаты исследования.
1. Руководство к лабораторным занятиям по биологической химии /Под ред. Т. Т. Березова. М: Медицина, 1976. 294 с.
2. Кушманова О. Л., Ивченко Г. М. Руководство к практическим занятиям по биологической химии. М: Медицина, 1983. 272 с.
3. Методические указания к лабораторным занятиям по биохимии /Под ред. В. В. Рудакова. Л., 1986. 54 с.
4. Кучеренко Н. Е., Бабенюк Ю. Д., Васильев А. Н. Биохимия: Практикум. Киев: Выща школа, 1988. 128 с.
5. Алейникова Т. Л., Рубцова Г. В. Руководство к практическим занятиям по биохимии. М: Высшая школа, 1988.
239 с.
5. Mазоr Л., Методы органического анализа, пер. с англ., M., 1986, с. 493; Kakac В., VejdelekZ.J., Handbuch der photometrischen Analyse organischer Verbindungen, Bd 1-2, Prague, 1974. Я. К. Куцева.
6. Досон Р. и др., Справочник биохимика. — М.: Мир, 1991.
 2015-10-16
2015-10-16 1364
1364