٭ Количественное определение мочевой кислоты в моче
Принцип метода. Метод основан на способности мочевой кислоты в щелочной среде восстанавливать фосфорновольфрамовый реактив. Количество восстановленного фосфорновольфрамового реактива, окрашенного интенсивный синий цвет, можно определить титрованием раствором K3[Fe(CN)6], который при этом окисляется с образованием бесцветного продукта. Количество K3[Fe(CN)6], израсходованного на окисление, эквивалентно количеству мочевой кислоты.
Ход определения. 1. В опытную пробирку вносят 2 мл мочи, в стандартную – 2 мл стандартного раствора мочевой кислоты (0,5 мг/мл). Затем в обе пробирки добавляют по 1 мл раствора NaOH и по 1 мл фосфорновольфрамового реактива. Появляется синее окрашивание.
2. Раствор титруют до обесцвечивания раствором K3[Fe(CN)6].
3. Рассчитывают концентрацию мочевой кислоты в опытной пробе по стандартной. Пример расчета: на титрование опытной пробы пошло 3 мл раствора K3[Fe(CN)6], на титрование стандартной пробы – 2 мл. Содержание мочевой кислоты в стандартном растворе 0,5 мг/мл.
Составляем пропорцию:
1 мг мочевой кислоты - 2 мл K3[Fe(CN)6]
Х мг мочевой кислоты - 3 мл K3[Fe(CN)6]
Отсюда в 2 мл исследуемой мочи содержится мочевой кислоты
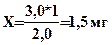
Затем рассчитываем количество мочевой кислоты в суточном количестве мочи (1,5-2 л). В норме в сутки выделяется 0,3 – 1,2 г мочевой кислоты.
Оформление работы. Записывают принцип метода, расчет, делают вывод.
 2015-10-16
2015-10-16 648
648







