Приложение 3
Насыщаемость ковалентной связи. Атом может образовывать ковалентную связь с другим атомом за счет неспаренного электрона (обменный механизм), а также за счет неподеленной электронной пары или вакантной орбитали (донорно-акцепторный механизм). Поскольку набор этих возможностей ограничен, ограничено и максимальное число ковалент-ных связей, которые может образовывать атом химического элемента. Поэтому говорят, что ковалентная связь характеризуется насыщаемостью. Например, атом водорода, обладающий единственным электроном на единственной 1 я-орби-гали, способен образовывать только одну ковалентную связь. Атом азота с электронной конфигурацией валентных электронов 2в22р3 может за счет трех неспаренных электронов образовывать три ковалентные связи по обменному механизму и четвертую — за счет пары 2в-электронов по донорно-акценторному, выступая при этом в роли донора. Таким образом, максимальная валентность азота равна четырем в отличие от высшей степени окисления, равной +5.
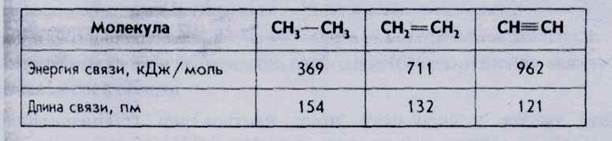
Кратность ковалентной связи. Число общих электронных пар, связывающих два атома в молекуле, называется кратностью ковалентной связи. Кратность влияет на энергию разрыва химической связи, а также на длину химической связи, т. е. межъядерное расстояние. Так, например, связь между атомами углерода в молекуле этана СгНб осуществляется за счет одной электронной пары, т. е. связь одинарная, ее кратность равна 1.
Связь в молекуле этилена СгН4 двойная (за счет двух электронных пар), ее кратность равна 2.
Связь в молекуле ацетилена СгЬЬ тройная, ее кратность равна 3. Сравним энергии и длины связей в этих молекулах (табл.16).
Итак, с увеличением кратности возрастает энергия разрыва связи и уменьшается длина связи.
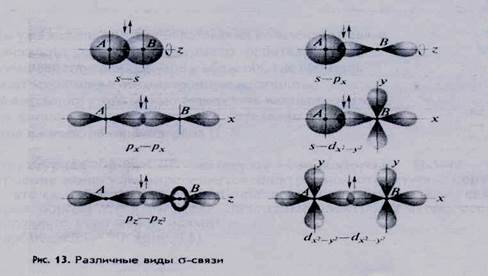
Типы ковалентной связи по способу перекрывания орбиталей. В зависимости от способа перекрывания электронных орбиталей различают - и -ковалентные связи.
Связь (сигма-связь) - - наиболее универсальный вид связи, которая образуется при перекрывании s—s-, s— р-, р — р - и других орбиталей (рис. 13).
Особенности - связи:
· область перекрывания (область повышенной электронной плотности) располагается на линии, соединяющей центры ядер атомов (линии связи);
· электронное облако (орбиталь) симметрично относительно линии связи. Такой вид симметрии называется цилиндрической или осевой, так как линия связи является для образующегося электронного облака осью вращения;
· возможно свободное вращение облака a-связи вокруг линии связи без ее
разрушения.
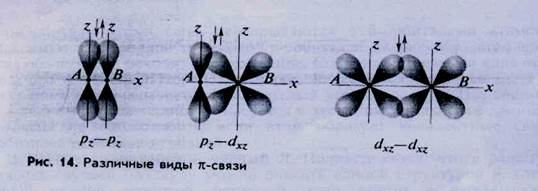
· Связъ (пи-связь) может возникать при взаимодействии р—р-,p-d или d-d-орбиталей
· (рис. 14).
· Признаки - связи:
· образуются две области перекрывания (повышенной электронной плотности), ни одна из которых не лежит на линии связи;
· электронное облако (орбиталь) симметрично относительно плоскости, проходящей через линию связи и перпендикулярно осям орбиталей. Такой вид симметрии называется зеркальной или плоскостной;
· вокруг линии связи невозможно свободное (без разрушения связи) вращение образовавшегося облака.
Направленность ковалентной связи. Если один и тот же атом образует несколько ковалентных связей, то они располагаются в пространстве под определенными углами. Направленность ковалентной связи обусловлена тем, что р-, d- и f-орбитали определенным образом ориентированы в пространстве. Направленность ковалентной связи влияет на форму молекул веществ, их размеры, межатомные расстояния, валентный угол, т. е. на геометрию молекул.
| Мы уже видели, что при образовании ковалентной связи происходит перекрывание атомных орбиталей взаимодействующих атомов в областях, где орбиталь имеет максимальную электронную плотность. На основании этого можно определить валентные углы для данной молекулы. Например, определим валентный угол в молекуле сероводорода Н 2S. |  |
Структурная формула молекулы сероводорода H-S-H. Пространственное строение молекулы определяется электронной структурой центрального атома, т. е. атома, образующего наибольшее число химических связей. В молекуле сероводорода это атом серы. Валентные электроны атома серы находятся на А- подуровне, угол между осями р-орбиталей — 90° (рис. 15).
р-Орбитали атома серы перекрываются с 8-орбиталями атомов водорода. Максимум электронной плотности р-орбиталей на рисунке затемнен. Именно в этих областях происходит перекрывание. Соединив отрезками ядра атомов Н и 8, получим валентный угол. Из рисунка видно, что он должен быть равен 90°. Эксперимент показывает, что валентный угол в молекуле H2S составляет 92°, т. е. в данном случае теория согласуется с экспериментальными данными. Однако согласия не наблюдается, если атом образует ковалентные связи за счет орбиталей разных подуровней.
В 1931 г. американский ученый Л. Полингдоказал, что в ряде практически важных случаев молекулу можно описать единой структурой и, следовательно, одной полной волновой функцией, если ввести в рассмотрение теорию гибридизации атомных орбиталей.
Гибридизация атомных орбиталей — это смешение различных атомных орбиталей данного атома в процессе его химического взаимодействия с другими атомами, приводящее к образованию гибридных орбиталей, локализованных в области между двумя атомами.
Рассмотрим понятие «гибридизация» на примере атома углерода и молекулы метана СН4.
Атом углерода имеет электронную конфигурацию
6С ls22s22p2
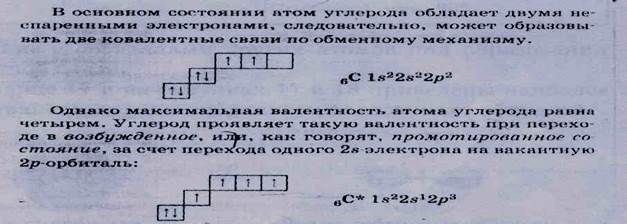

Таблица 17
 2015-10-16
2015-10-16 3238
3238