Горение – это химическая реакция окисления горючего с кислородом, протекающая сравнительно быстро во времени с выделением большого количества теплоты.
В процессе горения продукты сгорания нагреваются до высоких температур.
Общее уравнение горения любого углеводородного газа с кислородом имеет следующий вид:
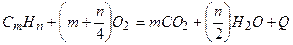 , (3.1)
, (3.1)
где m и n – соответственно количество атомов углерода и водорода в молекуле
газа;
Q – тепловой эффект реакции окисления.
В таблице 3.1приведены реакции горения основных горючих газов с кислородом.
Реакции горения горючих газов с кислородом
Таблица 3.1
В таблице 3.1приведены реакции окисления наиболее известных горючих газов с кислородом. Однако в реальных условиях окислитель (кислород) подается в зону горения не чистом виде, а в составе воздуха. Известно, что воздух, в основном состоит из двух частей: кислорода и азота. В состав воздуха входит также в незначительном количестве двуокись углерода СО2, а также редкие газы. Учитывая их незначительное количество в составе воздуха, то ими пренебрегаем.
Таким образом, если мы примем объем воздуха за 100%, то содержание кислорода составит 21%, а азота 79%. Следовательно, на 1 м 3 кислорода воздуха приходиться 79/21 = 3.76 м 3 азота, или 1 м 3 кислорода содержится в 100/21 = 4.76 м 3 воздуха.
Учитывая выше изложенные соотношения, мы можем записать общее уравнение горения углеводородов с воздухом:
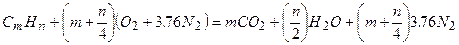 . (3.2)
. (3.2)
В таблице 3.2 приведены уравнения реакции горения горючих газов с воздухом.
Следует отметить, что приведенные в таблицах 3.1 и 3.2 уравнения являются стехиометрическими, т.е. такое соотношение горючего газа и окислителя (кислорода, воздуха), при котором горючему газу подается теоретически необходимое количество окислителя. Однако в практике сжигания газа в реальных условиях приходится подавать в зону несколько больше окислителя, чем это следует из стехиометрических уравнений. Это связано, главным образом с несовершенством качества перемешивания горючего газа и окислителя.
Уравнения реакций горения горючих газов с воздухом
Таблица 3.2
Отношение действительного расхода окислителя (кислорода или воздуха) к теоретически необходимому называется коэффициентом избытка воздуха и обозначается α, т.е.:
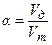 , (3.3)
, (3.3)
где Vд – действительный расход воздуха;
Vт – теоретически необходимое количество воздуха.
В таблице 3.3 приведены значения теоретически необходимого количества окислителя (кислорода и воздуха), а также объема продуктов сгорания при сжигании 1 м 3 газа и коэффициенте избытка воздуха равном 1 (a = 1).
Теоретически необходимое количество окислителя и объем продуктов сгорания при сжигании 1 м 3 при α = 1
Таблица 3.3
В практических расчетах иногда нам не известен химический состав газов, а известна лишь теплота сгорания. Необходимо определить теоретически необходимое количество воздуха, необходимое для полного сжигания 1 м 3 газа.
Для этого случая имеется эмпирическая формула Д.И. Менделеева:
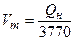 , (3.4)
, (3.4)
где Qн – низшая теплота сгорания газа, кДж / м 3.
Уравнения реакций горения различных газов с кислородом и воздухом отражает лишь соотношение между горючим и окислителем, а не объясняют механизма протекания этих реакций. В реальных условиях процесс горения значительно сложнее.
Разработал современную теорию механизма кинетики реакции горения газов советский ученый, академик Н.Н. Семенов [67,68]. Согласно его теории в пламени газовоздушной смеси протекают цепные реакции горения газов. В результате чего образуются промежуточные нестойкие продукты в виде свободных атомов радикалов. В соответствии с теорией Н.Н. Семенова реакция горения водорода с кислородом не сводится просто к соединению двух молекул водорода и одной кислорода с образованием двух молекул воды. В ходе взаимодействия этих двух газов сначала происходит образование промежуточных веществ в виде атомов водорода и кислорода, а также происходит образование свободных гидроксильных радикалов ОН.
Для начала процесса горения необходимо каким-то образом активизировать горючую смесь. Иными словами необходимо создать такие условия, при которых реагенты будут обладать большим запасом энергии. Этот запас энергии необходим для реализации процесса горения. Указанный выше запас энергии может быть создан подогревом газовоздушной смеси до температуры ее воспламенения. Эта энергия, называемая энергией активации, необходима главным образом для того, чтобы разрушить имеющиеся межмолекулярные связи в реагентах.
В процессе горения происходит непрерывное образование новых связей наряду с разрушением старых. При образовании новых связей происходит значительное выделение энергии, в то время как разрыв старых связей сопровождается всегда затратами энергии. Благодаря тому, что в процессе горения энергия, которая выделяется при образовании новых связей, имеет большое значение, по сравнению с энергией, затраченной на разрыв старых связей, суммарный тепловой эффект остается положительным.
Реакция водорода с кислородом является наиболее простой и изученной. Поэтому рассмотрим эту разветвленную реакцию на примере.
В соответствии с теорией Н.Н. Семенова в начальный момент реакции, в результате энергии активации и столкновения молекул водорода и кислорода, происходит образование двух гидроксильных радикалов ОН:
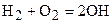 . (3.5)
. (3.5)
Далее радикал ОН реагирует с молекулой водорода, в результате чего образуются молекулы воды и свободный атом водорода Н, т.е.:
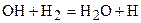 . (3.6)
. (3.6)
Свободный же атом водорода Н, в свою очередь, вступает в реакцию с молекулой кислорода. В результате чего образуется гидроксильный радикал ОН и свободный атом кислорода т.е.:
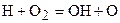 . (3.7)
. (3.7)
Радикал может опять вступить в химическую реакцию с водородом и опять, в результате реакции, образовать воду и свободный водород, а атом кислорода, в свою очередь, может вступить в реакцию с молекулой водорода, что приведет к образованию еще одного радикала ОН и атома водород Н, т.е.:
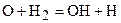 . (3.8)
. (3.8)
Указанный выше механизм цепной реакции горения водорода с кислородом показывает возможность многократного взаимодействия одного радикала ОН с атомами водорода. В результате этого взаимодействия образуются молекулы воды.
Следовательно, свободные атомы и радикалы являются активными центрами при создании цепной реакции.
Реакцию горения водорода с кислородом, объясняющую механизм цепной реакции, можно записать так:
H2O O + (H2)…
ä ä
OH + (H2) ® H +(O2) ® OH + (H2)…
ä
H + O2 (3.9)
æ
O + (H2) ® OH +(H2) ® H2O
æ
H +(O2) ® OH +H2…
æ
O + H2…
Механизм горения окиси углерода с кислородом отличается большей сложностью. По данным ученых Института Химической физики АН СССР окись углерода не вступает в реакцию с сухим кислородом. Ими было установлено также, что добавление в смесь небольшого количества водорода или влаги приводит к началу реакции окисления. В результате происходит следующая последовательность химических реакций:
H2O ® OH + H; (3.10)
OH + CO ® CO2 + H; (3.11)
H + O2 ® OH + O; (3.12)
CO + OH ® CO2 + H; (3.13)
CO + O ® CO2; (3.14)
H + O2 = OH + O (3.15)
Как следует из приведенных химических реакций, наличие небольшого количества влаги приводит к образованию в зоне горения гидроксилов и свободных атомов. Как было отмечено ранее и гидроксильные радикалы, и свободные атомы являются инициаторами создания и носителями цепной реакции.
Еще более сложный механизм окисления углеводородов. Наряду с некоторым сходством с механизмом горения водорода и окиси углерода, механизм горения углеводородов имеет и ряд существенных отличий. Анализируя продукты сгорания, было установлено, что в них присутствуют альдегиды и главным образом формальдегид (НСНО).
Рассмотрим механизм окисления углеводородов на примере самого простого из них – метана. Механизм окисления метана проходит четыре стадии, на каждой из которых протекают следующие химические реакции:
На первой стадии:
H + O2 ® OH + O; (3.16)
CH4 + OH ® CH3 + H2O; (3.17)
CH4 + O ® CH2 + H2O. (3.18)
На второй стадии:
CH3 + O2 ® HCHO + OH; (3.19)
CH2 + O2 ® HCHO + O; (3.20)
На третьей стадии:
HCHO + OH ® HCO + H2O (3.21)
HCHO + O ®СО + H2O; (3.22)
HCO+ O2 ® CO + O + OH (3.23).
На четвертой стадии:
CO + O ® CO2 (3.24)
CO + OH ® CO2+H. (3.25)
 2015-10-13
2015-10-13 3612
3612
