Институт естественных и технических наук
Кафедра химии
ЛАБОРАТОРНАЯ РАБОТА № 6
КОМПЛЕКСОНОМЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ СУЛЬФАТОВ
В ПРИРОДНЫХ ВОДАХ
(методические указания к лабораторным работам для слушателей курсов повышения квалификации по программе
«Химическая технология органических и неорганических веществ.
Модуль 1. Основы химического анализа веществ.
Анализ природных и промышленных вод)
Сургут, 2015
Комплексонометрическое определение
Принцип метода
Метод основан на осаждении сульфат-ионов хлоридом бария. Осадок сульфата бария растворяют в титрованном растворе этилендиаминатетраацитата натрия, избыток которого определяют титрованием хлорида магния. Метод применим для малых концентраций сульфатов. При содержании сульфатов 50 мг/л пробу концентрируют упариванием, а более 250 мг/л – пробу разбавляют. Оптимальный интервал концентраций сульфатов для определения – от 5 до 20 мг/л в анализируемом объеме.
SO42- + Ba2+ = BaSO4
BaSO4 + Y4- = BaY2- + SO42+
Реактивы:
1. Бидистиллированная вода, перегнанная в стеклянном приборе, не содержащая меди. На этой воде готовят все реактивы и этой водой разбавляют пробы.
|
|
|
2. Хлорид бария, 0.05 н., раствор.
В дистиллированной воде растворяют 6.108 г ВаCl2.2 H2Oдоводят объем до 1 л.
3. Хлорид_магния 0.05 н. раствор. Растворяют 5.085 г MgCl2 . 5H2O в дистиллированной воде и доводят объем до 1 л.
4. Этилендиаминтетраацетат натрия (трилон Б, комплексон III, Nа2ЭДТА), 0.05 н. раствор.
5..Индикатор эриохром чёрный 'Т (хромоген черный Т, хром черный ЕТ-00, кислотный хром черный).
8. Аммиачный буферный раствор.
9. Аммиак, 9 н. раствор Разбавляют 67 мл 25% аммиака дистиллированной водой до 100 мл.
10. Хлороводородная кислота, пл. 1.19 г/см3.
Ход определения
В коническую колбу вмёстимостью 250 мл помещают 100 мл исследуемой воды, (при необходимости разбавленной). В этой же колбе, если необходимо, концентрируют сульфаты выпариванием подкисленного раствора, не допуская кипения, подливая по мере выпаривания новую порцию исследуемой воды. Раствор подкисляют 3 каплями концентрированной хлороводородной кислоты до кислой реакции, прибавляют 25 мл 0.05 н. хлорида бария, нагревают до кипения, кипятят точно 10 мин от начала кипения и оставляют на водяной бане около 1 ч.
Через 1 ч раствор фильтруют обычным способом через небольшой беззольный фильтр «синяя лента», предварительно промытый горячей, дистиллированной водой. Фильтруют, по возможности не перенося осадок сульфата бария на фильтр. Колбу с осадком промывают 5 - 6 раз умеренно горячей водой (40 - 50 °С), не счищая приставшего к стенкам колбы осадка, и пропускают промывные воды через тот же фильтр.
Фильтр с частью попавшего на него осадка сульфата бария промывают 2 - 3 раза водой до отрицательной реакций на хлорид-ион. Когда вода стечет, фильтр с осадком помещают в ту же колбу, в которой проводили осаждение. Приливают 5 мл 9 н. аммиака, фильтр осторожно разворачивают стеклянной палочкой и расправляют на дне колбы. Затем добавляют 6 мл 0.05 н. трилона Б на каждые 5 мг предполагаемого количества сульфатов во взятом объеме исследуемой воды (приближенное определение описано в гравиметрическом методе).
|
|
|
Содержимое колбы осторожно нагревают на песчаной бане до кипения и кипятят до растворения осадка (3 - 5 мин), держа колбу в наклонном положении и периодически помешивая жидкость. Раствор охлаждают, приливают 50 мл дистиллированной воды, 5 мл аммиачного буферного раствора и прибавляют индикатор (0.1 г сухого индикатора или 5 капель спиртового раствора). Избыток трилона Б титруют 0.05 н. раствором хлорида магния до перехода окраски из синей в лиловую.
Концентрацию сульфатов (мг/л) рассчитывают по формуле:
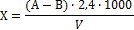
где А — объем прибавленного раствора трилона Б,
мл; В — объем раствора хлорида магния, израсходованного на титрование, мл;
2.4 — количество сульфатов, эквивалентное 1 мл 0.05 н. трилона Б;
V — объем пробы воды, взятой для анализа, мл.
 2015-10-13
2015-10-13 2387
2387