1. Молярную массу воздуха m=29×10-3 кг/моль и объем колбы внести в табл.2. Объем колбы указан на жестком основании 8.
2. Температуру в лаборатории в градусах Цельсия, измеренную с помощью настенного термометра, перевести в кельвины, воспользовавшись соотношением 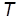 (К) @
(К) @ 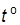 С+273 К. Значение
С+273 К. Значение 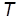 внести в табл. 2.
внести в табл. 2.
3. При отсоединенном от колбы гибком шланге 4 и открытом на атмосферу вакуумном кране взвесить колбу и значение 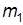 внести в табл. 2.
внести в табл. 2.
4. При открытом вакуумном кране подсоединить к колбе гибкий шланг 4. Стрелка манометра при этом должна показывать нулевое избыточное давление.
5. Привести в действие насос, вращая маховое колесо против часовой стрелки до тех пор, пока стрелка манометра не установится вблизи отрицательного избыточного давления 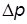 , равного
, равного
–0,7 кгс/см2.
6. Снять показание манометра. Перекрыть вакуумный кран и только после этого остановить насос. Перевести 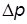 в паскали
в паскали
(с помощью соотношения 1 кгс/см2 @ 9,81×104 Па) и внести его в табл.2.
7. Отсоединить от колбы гибкий шланг 4 и взвесить колбу. Значение 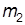 внести в табл. 2.
внести в табл. 2.
8. С помощью уравнения (18) вычислить величину универсальной газовой постоянной 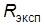 и внести ее в табл. 2.
и внести ее в табл. 2.
9. Повторить пп. 3-8 при немного отличающихся значениях избыточного давления 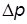 с тем, чтобы получить три значения
с тем, чтобы получить три значения 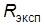 . Рассчитать среднее значение измеренной универсальной газовой постоянной
. Рассчитать среднее значение измеренной универсальной газовой постоянной 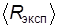 и внести его в табл. 2.
и внести его в табл. 2.
10. Вычислить относительную погрешность 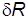 измерения универсальной газовой постоянной, воспользовавшись формулой
измерения универсальной газовой постоянной, воспользовавшись формулой
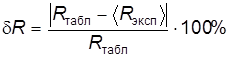 , (19)
, (19)
где 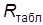 – –
| значение универсальной газовой постоянной, взятое из табл. 1. |
Величину погрешности 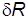 внести в табл. 2.
внести в табл. 2.
Таблица 2
| № опы-та | m, кг/моль | 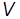 , м3 , м3
| 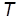 , К , К
| 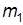 , кг , кг
| 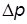 , Па , Па
| 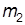 , кг , кг
| 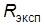 , Дж/(моль К) , Дж/(моль К)
| 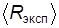 , Дж/(моль К) , Дж/(моль К)
| 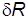 , % , %
|
Контрольные вопросы
1. Модель идеального газа.
2. Уравнение состояния идеального газа и его разные формы записи.
3. Опытные газовые законы.
4. Физический смысл универсальной газовой постоянной.
5. Цель и порядок выполнения лабораторной работы.
 2015-10-13
2015-10-13 218
218








