Марганец – элемент 4‑го периода и VIIB‑группы Периодической системы, порядковый номер 25. Электронная формула атома [18Ar]3d54s2; характерные степени окисления +VII, +VI, +IV, +II и 0.
Шкала степеней окисления марганца:
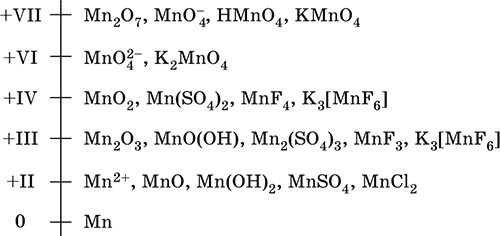
По электроотрицательности (1,60) марганец занимает промежуточное положение между типичными металлами (Na, К, Са, Mg) и неметаллами (F, О, N, Cl). Соединения MnII – оксид и гидроксид – проявляют основные свойства, соединения MnIII и MnIV – амфотерные свойства, для соединений MnVI и MnVII характерно почти полное преобладание кислотных свойств. Марганец образует многочисленные соли и бинарные соединения.
В природе – четырнадцатый по химической распространенности элемент (восьмой среди металлов; второй, после железа, тяжелый металл).
Марганец Mn. Серебристо‑белый (с серым оттенком) металл, более твердый и хрупкий по сравнению с железом. В виде мелкого порошка пирофорен. На воздухе покрывается оксидной пленкой. Пассивируется в воде, поглощает водород, но не реагирует с ним.
При нагревании сгорает в кислороде воздуха, реагирует с хлором и серой:
|
|
|
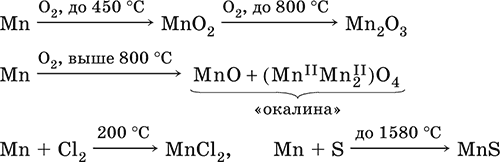
В ряду напряжений марганец стоит левее водорода, из разбавленных кислот HCl и H2SO4 вытесняет водород:
Mn (порошок) + 2H+ = Mn2+ + Н2↑
Взаимодействует с кислотами‑окислителями при нагревании, также образуя соли марганца (II):
Mn + 2H2SO4 (конц.) = MnSO4 + SO2↑ + 2Н2O
ЗMn + 8HNO3 (разб.) = 3Mn(NO3)2 + 2NO↑ + 4Н2O
Получение марганца в промышленности – восстановление пиролюзита MnO2 или гаусманита (MnIIMn2III)O4 коксом или алюминием:
MnO2 + С (кокс) = Mn + СO2 (600 °C)
3(MnIIMn2III)O4 + 8Al = 9 Mn + 4Al2O3 (700–900 °C)
Наиболее чистый марганец выделяют электролизом раствора из солей марганца(II), например:
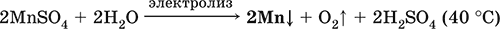
Промышленно важен сплав с железом – ферромарганец (> 70 % Mn), его получают восстановлением оксидных руд марганца и железа.
Применяется марганец для изготовления специальных и тугоплавких сплавов, зеркального чугуна и марганцевых твердых сталей, в качестве катализатора в органическом синтезе.
Оксид марганца (IV) MnO2. Черный, с коричневым оттенком, при нагревании разлагается. Из раствора осаждается в виде черного гидрата MnO2 nН2O. Не проявляет амфотерных свойств в силу малой реакционной способности по отношению к воде, разбавленным кислотам НCl и H2SO4, азотной кислоте и щелочам в растворе. Типичный окислитель в растворе и расплаве, менее характерны свойства восстановителя.
Применяется для промышленного производства марганца, как деполяризатор в «батарейках» (сухих гальванических элементах), компонент минеральных пигментов, осветлитель стекла.
Уравнения важнейших реакций:
4MnO2 = 2Mn2O3 + O2 (530–585 °C)
2MnO2 + 2H2SO4 (конц.) = MnSO4 + O2↑ + 2Н2O (кипячение)
MnO2 + 4HCl (конц.) = MnCl2 + Cl2↑ + 2H2O
MnO2 + H2SO4 (гор.) + KNO2 = MnSO4 + KNO3 + H2O
|
|
|
MnO2 + 2H2SO4 + 2FeSO4 = MnSO4 + Fe2(SO4)3 + 2H2O
MnO2 + 2KOH + KNO3 = K2MnO4 + KNO2 + H2O (350–450 °C)
3MnO2 + 3K2CO3 + KClO3 = 3K2MnO4 + KCl + 3CO2 (400 °C)
В природе самое распространенное соединение марганца – минерал пиролюзит.
Манганат калия К2MnO4. Оксосоль. Темно‑зеленый, плавится под избыточным давлением O2. В растворе устойчив только в сильнощелочной среде. Зеленая окраска раствора отвечает иону MnO42‑. Медленно разлагается при разбавлении раствора водой, быстро – при подкислении. Проявляет окислительно‑восстановительные свойства.
Качественная реакция – появление фиолетовой окраски при подкислении раствора. Промежуточный продукт при синтезе КMnO4.
Уравнения важнейших реакций:
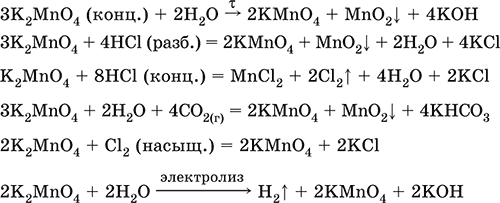
Получение: сплавление MnO2 с сильными окислителями (KNO3, КСlO3).
Пермапгапат калия КMnO4. Оксосоль. Красно‑фиолетовый (почти черный). При нагревании разлагается без плавления. Умеренно растворим в воде (интенсивно‑фиолетовая окраска раствора отвечает иону MnO4‑), гидролиза нет. Медленно разлагается в воде, серной кислоте, щелочах. Сильный окислитель в растворе и при сплавлении; в сильнокислотной среде восстанавливается до MnII, в нейтральной среде – до MnIV, в сильнощелочной среде – до MnVI.
Качественная реакция на ион MnO4‑ – исчезновение фиолетовой окраски раствора при восстановлении в кислотной среде.
Применяется как окислитель углеводородов до карбоновых кислот, реактив в фотографии, антисептик в медицине, средство для очистки газов и отбеливания тканей, твердый источник кислорода. Распространенный окислитель в лабораторной практике.
Уравнения важнейших реакций:
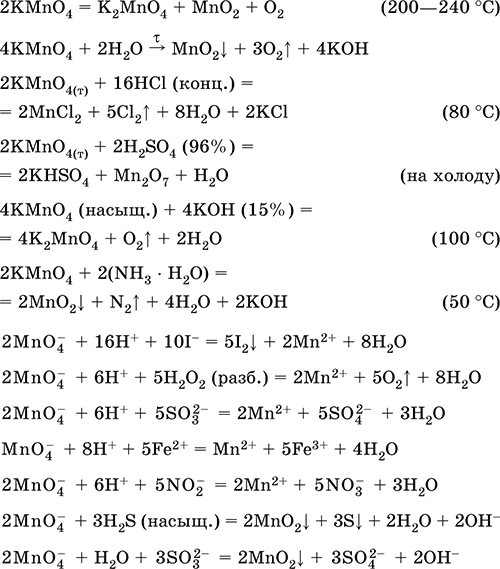
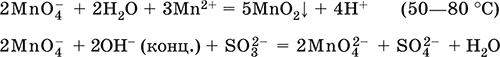
Получение – электролиз раствора K2MnO4 (см.).
Железо
Железо – элемент 4‑го периода и VIIIБ‑группы Периодической системы, порядковый номер 26. Вместе с кобальтом Со и никелем Ni образует семейство (триаду) железа. Электронная формула атома [18Ar]3d64s2, характерные степени окисления 0, +II и +III (последняя наиболее устойчива).
Шкала степеней окисления железа:
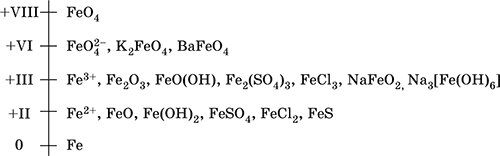
По электроотрицательности (1,64) железо занимает промежуточное положение между типичными металлами (Na, Са) и типичными неметаллами (F, О, N). Проявляет амфотерные свойства, металлические (основные) свойства преобладают над неметаллическими (кислотными), в соединениях находится в составе катионов (чаще) и анионов (реже). Образует многочисленные соли и бинарные соединения.
В природе – седьмой по химической распространенности элемент (четвертый среди металлов, первый тяжелый металл); находится в химически связанном виде. Жизненно важный элемент для всех организмов.
Железо Fe. Простое вещество. Серый мягкий, ковкий, тугоплавкий металл. Обычное железо медленно окисляется во влажном воздухе (ржавеет), чистое железо коррозии не подвергается. Не реагирует с водой, пассивируется в концентрированных серной и азотной кислотах.
Компактный металл покрывается при нагревании на воздухе оксидной пленкой (окалиной), а порошок сгорает; реагирует с хлором и серой:
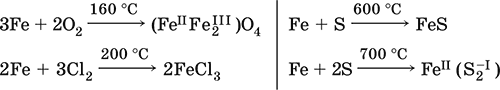
Восстанавливает водяной пар (старый способ получения водорода в промышленности):
3Fe + 4Н2O (пар) = (FeIIFe2III)O4+ 4Н2 (800 °C)
В ряду напряжений стоит левее водорода, реагирует с разбавленными кислотами НCl и H2SO4, при этом образуются соли железа(II) и выделяется водород:
Fe + 2Н+ = Fe2+ + Н2↑
(реакции проводятся без доступа воздуха, иначе FeII постепенно переводится кислородом в FeIII).
При действии на железо более сильного окислителя (здесь – азотная кислота) оно сразу переходит в катион Fe3+:
Fe + 4HNO3 (разб.) = Fe(NO3)3 + NO↑ + 2H2O
Амфотерность железа проявляется только в концентрированных щелочах при кипячении:
Fe + 2NaOH (50 %) + 2Н2O = Na2[Fe(OH)4]↓ + Н2↑
и образуется осадок тетрагидроксоферрата(II) натрия.
Железо вытесняет (по ряду напряжений) менее активные металлы из растворов их солей:
Fe + CuSO4 = FeSO4 + Cu↓
Железо медленно окисляется во влажном воздухе (ржавеет), из‑за рыхлости коричневой ржавчины (FeIIFe2III)O4 защитный слой не создается. Процесс ржавления:
|
|
|
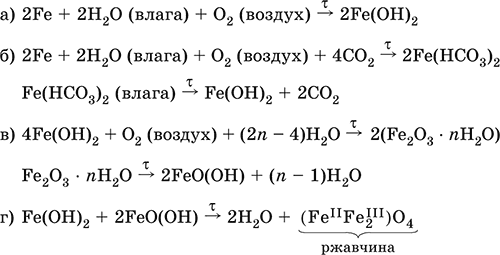
Техническое железо – сплавы железа с углеродом: чугун содержит 2,06–6,67 % С, сталь 0,02–2,06 % С, часто присутствуют другие естественные примеси (S, Р, Si) и вводимые искусственно специальные добавки (Mn, Ni, Cr), что придает сплавам железа технически полезные свойства – твердость, термическую и коррозионную стойкость, ковкость и др.
 2015-10-13
2015-10-13 3430
3430








