Правило фаз Гиббса
Основным законом фазового равновесия является правило фаз Гиббса. Оно представляет собой математическое выражение условий равновесия системы, т.е. показывает количественную зависимость между числом степеней свободы системы (С), числом независимых компонентов (К) и числом фаз (Ф):
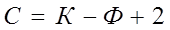 . (3.1)
. (3.1)
Правило фаз Гиббса: в равновесной термодинамической системе, на которую из внешних факторов оказывают влияние только температура и давление, число термодинамических степеней свободы равно числу компонентов минус число фаз плюс два.
Если на равновесие в системе влияет n внешних факторов, то правило фаз Гиббса имеет вид:
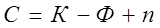 . (3.2)
. (3.2)
Из уравнения (3.2) следует, что число степеней свободы (С) возрастает с увеличением числа независимых компонентов (К) и уменьшается при росте числа фаз (Ф). При С=0 в равновесии находится наибольшее число фаз. В общем случае, число фаз не может быть больше К+n (при С=0):
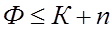 .
.
Если учитывать влияние только одного внешнего параметра, температуры при р=const, правило фаз Гиббса запишется:
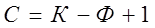 . (3.3)
. (3.3)
Вариантность системы в данном случае называют условной. Уравнение (3.4) используют на практике проведения большинства металлургических процессов.
Из правила фаз следует, что для однокомпонентной системы максимальное число фаз определяется из условия:
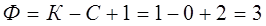 .
.
Для двухкомпонентной системы:
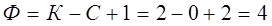 .
.
Правилу фаз Гиббса не подчиняются коллоидные системы, в которых дисперсная фаза микроскопических размеров (фазы должны обладать макроскопическими размерами и поверхностную энергию можно не учитывать). Правило фаз неприменимо к неравновесным метастабильным состояниям (переохлажденная вода, перегретый пар и т.д.).
 2015-10-13
2015-10-13 4836
4836
