В современном городе одной из главных экологических проблем является загрязнение атмосферного воздуха многочисленными источниками, без которых город не может существовать. Прежде всего, это отопительная система жилья, которая поставляют тепло в жилые дома. Эта система потребляет около 25% топлива, при этом выбрасывает в атмосферу 30% разнообразных вредных веществ. Основными загрязнителями являются продукты полного (оксиды серы и зола) и неполного (главным образом, оксид углерода, сажа и углеводороды) сгорания. Важную роль играют оксиды азота, которые получаются преимущественно из азота воздуха при высоких температурах горения. Небольшие отопительные и технологические установки дают мало оксидов азота, но могут выбрасывать довольно большое количество продуктов неполного сгорания, в особенности сажистых частичек, которые отличаются от других видов твердых загрязнителей своей способностью вызывать злокачественные заболевания.
Отдельную проблему несут котельные, работающие на твердом топливе, в частности, угле. Большинство типов углей при сгорании дают большое количество серного ангидрида (SO2), например, при сгорании 1 тыс. т угля, содержащем 1% серы в своем составе, в атмосферу выбрасывается 0,65 т этого загрязнителя, который при взаимодействии с влагой воздуха может на протяжении 4 суток превратиться в 1 т серной кислоты. Эта кислота вместе с осадками поступает в почву и в водоемы, являясь причиной их закисления.
В водоеме при систематическом выпадении кислотных осадков вода начинает закисляться, что первоначально приводит к снижению в ней кальция и гибели некоторых земноводных (рН<7). При рН <6,6 начинают погибать улитки, а при рН <5 быстро сокращается численность и резкое уменьшение видового разнообразия водной фауны. Гибель микроорганизмов, разлагающих органику, приводит к скапливанию на дне водохранилища органических остатков. Гибнет планктон – основание пищевой пирамиды водных экосистем. Нарушенное кальциевое равновесие в системе “вода – водные организмы” у некоторых видов рыб приводит к потере способности образовывать икру. При рН<5,5 кислотолюбивые мхи и водоросли заглушают почти всю водную растительность, гибнут лягушки и многие насекомые. В воде водоемов в этих условиях гибнут микроорганизмы, разлагающие органику, и она вся оседает на дно нетронутой. Сухопутный мох сфагнум хорошо чувствует себя в таких условиях и ведет себя как настоящее водное растение, образуя с другими водорослями на дне водоема плотный ковер, препятствующий поступлению из донных осадков питательных веществ. Под этим «ковром» полностью иссякают запасы кислорода и создаются условия для развития бактерий-анаэробов, выделяющих углекислоту, метан, и сероводород. Водоем превращается в болото. Так мы описываем развитие ситуации в единичном случае. В целом проблема закисления водоемов стоит чрезвычайно остро для многих регионов земного шара, причем, часто из-за трансграничного переноса техногенных потоков серного ангидрида. Рассмотрение процессов переноса техногенных загрязнений из атмосферного воздуха показывает, что эта абиотическая среда в силу ее особенностей (малой плотности, больших скоростей движения воздушных масс, высокого содержания кислорода, наличия солнечного света) способствует развитию вторичных эффектов (кислотные дожди), зачастую наносящих значительно больший ущерб, чем первичные (прямое воздействие серного ангидрида).
Цель работы. Исследование содержания кальция в образцах воды из водоемов и установление зависимости между концентрацией ионов кальция и кислотностью среды.
Приборы и оборудование. Для выполнения работы используется лабораторный рН-метр типа рН-150.
Методика проведения работы. В химические стаканы емкостью 50мл помещают по 25 мл исследуемых образцов воды из водохранилищ и на рН-метре измеряют их значения рН. Дале проводят определение концентрации ионов кальция в исследуемых пробах. Для этого по 25 мл каждой пробы помещают в конические колбы объемом 100-250мл, добавляют в каждую колбу по 8 мл 2Н раствора NaOH и на кончике шпателя сухую смесь мурексида с NaCI. Цвет раствора при этом должен быть розовым. Каждую пробу последовательно титруют раствором трилона Б (0,01Н раствор) до перехода розовой окраски в фиолетовую. Отмечают объем трилона Б, пошедшего на титрование и заносят данные эксперимента в таблицу.
Внимание! В вашем случае, если лабораторная работа не выполняется экспериментально в пределах лаборатории, вы должны использовать набор готовых экспериментальных данных из таблицы 3.1 методических указаний к выполнению практических работ. При этом вы должны выбрать не менее, чем два варианта экспериментальных данных. Варианты выбираются по вашему личному желанию, любые!
Таблица 3.1 - Экспериментальные данные значений рН образцов воды из водоемов и объема трилона Б, пошедшего на их титрование
| № эксперимента | Образец воды | Значение рН | Объем трилона Б,мл |
| 3,35 | |||
| 6,87 | |||
| 11,56 | |||
| 2,48 | |||
| 7,01 | |||
| 9,05 | |||
| 4,55 | |||
| 7,21 | |||
| 12,12 |
Внесите выбранные экспериментальные данные в таблицу 3.2.
Таблица 3.2 - Экспериментальные данные значений рН образцов воды из водоемов и объема трилона Б, пошедшего на их титрование
| № эксперимента | Образец воды | Значение рН | Объем трилона Б,мл |
Концентрацию ионов кальция в пробах воды рассчитывают по формуле:
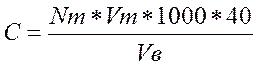
где С – концентрация ионов кальция в пробах, мг/л;
Vm – объем трилона Б, пошедшего на титрование, мл;
Nm – нормальность трилона Б, которая в нашем случае равняется 0,01;
Vв – объем пробы воды, взятой для анализа, мл (25 мл).
Полученные данные расчетов внесите в таблицу 3.3.
Таблица 3.3 – Результаты расчетов содержания кальция в воде водохранилищ
| № эксперимента | Образец воды | Значение рН | Объем трилона Б,,мл | Сионов кальция, мг/л |
Сделайте вывод, как закисление водоема влияет на содержание кальция в воде, установите зависимость между значением рН и концентрацией кальция.
Внимание! Проверьте правильность расчетов! (Таблица 3.4).
Таблица 3.4 - Правильные результаты расчетов к лабораторной работе №3
| № эксперимента | Образец воды | Значение рН | Объем трилона Б,мл | Сионов кальция, мг/л |
| 3,35 | ||||
| 6,87 | ||||
| 11,56 | ||||
| 2,48 | ||||
| 7,01 | ||||
| 9,05 | ||||
| 4,55 | ||||
| 7,21 | ||||
| 12,12 |
Тест-контроль.
3.1. Как связано закисление водоемов с нарушением кальциевого равновесия в системе «вода – водные организмы»?
«А» – с увеличением степени закисления уменьшается количество растворимых солей кальция в воде.
«Б» – с увеличением степени закисления возрастает и содержание растворимых солей кальция в воде.
«В» – с увеличением закисления содержание растворимых соединений кальция в воде водохранилищ не изменяется.
3.2. К каким типам загрязнений принадлежат закисления водоемов?
«А» - к первичным.
«Б» – ко вторичным.
«В» – к физическим.
 2015-10-13
2015-10-13 885
885








